题目内容
【题目】(1)银作为催化剂,主要用于乙烯氧化制环氧乙烷、甲醇氧化制甲醛等。目前银催化剂的市场需求呈逐年增加的趋势。请写出甲醇在银催化下制备甲醛的化学方程式
________________________________________________________________。
(2)银催化剂在使用过程中,催化活性逐渐减弱、选择性降低,一定时间后必须更换。某工厂对失效银催化剂进行回收并实现再生,工艺流程如下:

已知:银催化剂主要成分(X射线荧光光谱法分析)
元素 | Al2O3 | Ag | MgO | SiO2 | K2O | Fe2O3 |
含量% | 82 | 14.8 | 1.4 | 0.9 | 0.5 | 0.1 |
资料:经X射线衍射仪检测,其中氧化铝的晶型为α型,难于酸。
①操作a和操作b的名称是_________。
②请写出过程Ⅰ中银与稀硝酸反应的离子方程式
________________________________________________________________。
(3)滤液2 中含有多种金属离子,请简述检验其中K+的实验方法
____________________________________________________________________。
(4)结合化学用语从平衡移动角度解释过程Ⅲ中用氨水将氯化银沉淀溶解的原
因_______________________________________________________________。
(5)过程Ⅳ采用肼(N2H4)作为还原剂,具有不混入金属杂质、还原性强、得到银纯度高等优点,该过程的化学方程式为:
________________________________________________________。
(6)利用过程Ⅴ实现银催化剂再生,其简易装置图如下:

写出催化剂再生的电极反应式:________________________________。
【答案】 2CH3OH+O2 ![]() 2HCHO+2H2O 过滤 3Ag + NO3- + 4H+ =3Ag+ + NO↑+ 2H2O 用稀盐酸洗净铂丝,于酒精灯火焰上灼烧至与酒精灯火焰颜色一致;用铂丝蘸取滤液2,置于酒精灯火焰上灼烧,(利用焰色反应)透过蓝色钴玻璃观察火焰颜色呈紫色,证明滤液2中含有K+ AgCl(s)
2HCHO+2H2O 过滤 3Ag + NO3- + 4H+ =3Ag+ + NO↑+ 2H2O 用稀盐酸洗净铂丝,于酒精灯火焰上灼烧至与酒精灯火焰颜色一致;用铂丝蘸取滤液2,置于酒精灯火焰上灼烧,(利用焰色反应)透过蓝色钴玻璃观察火焰颜色呈紫色,证明滤液2中含有K+ AgCl(s) ![]() Ag+(aq)+Cl-(aq),Ag++2NH3= Ag(NH3)2+,导致Ag+浓度降低,平衡正向移动,氯化银转化成为溶液,有利于过程Ⅳ用肼进行还原。 4Ag(NH3)2Cl+N2H4 =4Ag+N2↑+4NH4C1+4NH3 Ag+ +e-= Ag
Ag+(aq)+Cl-(aq),Ag++2NH3= Ag(NH3)2+,导致Ag+浓度降低,平衡正向移动,氯化银转化成为溶液,有利于过程Ⅳ用肼进行还原。 4Ag(NH3)2Cl+N2H4 =4Ag+N2↑+4NH4C1+4NH3 Ag+ +e-= Ag
【解析】试题分析:(1)甲醇在银催化下是甲醛和水。
(2)①作a和操作b都是从溶液中分离出固体。
②银与稀硝酸反应生成硝酸银、NO、水。
(3)用焰色反应检验K+。
(4)AgCl(s) ![]() Ag+(aq)+Cl-(aq),Ag++2NH3= Ag(NH3)2+,导致Ag+浓度降低,平衡正向移动。
Ag+(aq)+Cl-(aq),Ag++2NH3= Ag(NH3)2+,导致Ag+浓度降低,平衡正向移动。
(5)(N2H4)作为还原剂,银离子被还原为银,肼被氧化为氮气。
(6)催化剂在阴极再生;
解析:(1)甲醇在银催化下是甲醛和水的方程式为2CH3OH+O2 ![]() 2HCHO+2H2O。
2HCHO+2H2O。
(2)①作a和操作b都是从溶液中分离出固体,操作名称是过滤。
②银与稀硝酸反应生成硝酸银、NO、水的方程式为3Ag + NO3- + 4H+ =3Ag+ + NO↑+ 2H2O 。
(3)用焰色反应检验K+的方法是用稀盐酸洗净铂丝,于酒精灯火焰上灼烧至与酒精灯火焰颜色一致;用铂丝蘸取滤液2,置于酒精灯火焰上灼烧,(利用焰色反应)透过蓝色钴玻璃观察火焰颜色呈紫色,证明滤液2中含有K+ 。
(4)AgCl(s) ![]() Ag+(aq)+Cl-(aq),Ag++2NH3= Ag(NH3)2+,导致Ag+浓度降低,平衡正向移动,所以加入氨水后氯化银沉淀溶解,加快用肼进行还原的速率。
Ag+(aq)+Cl-(aq),Ag++2NH3= Ag(NH3)2+,导致Ag+浓度降低,平衡正向移动,所以加入氨水后氯化银沉淀溶解,加快用肼进行还原的速率。
(5)(N2H4)作为还原剂,银离子被还原为银,肼被氧化为氮气,方程式为4Ag(NH3)2Cl+N2H4 =4Ag+N2↑+4NH4C1+4NH3 。
(6)催化剂在阴极再生,方程式为Ag+ +e-= Ag;

【题目】碳酸亚铁(FeCO3)是一种重要的工业盐。某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH。
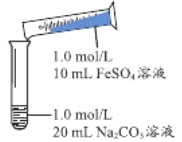
(1)实验探究Ⅰ
实 验 Ⅰ | 操作 | 现象 |
| 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
①生成FeCO3离子方程式:_________________________________。
②反应过程中可能生成Fe(OH)2的依据是__________________________________。
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有__________________________________。
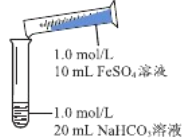
(2)实验探究Ⅱ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因______________________________________________。
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多。支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,___________________则结论成立。
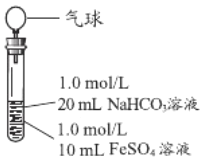
(3)实验探究Ⅲ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
实验改进的意图是____________。
(4)综合以上实验,下列说法正确的是__________
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1 L 1.0 mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116 g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3