题目内容
【题目】标准状况下有①6.72 L CH4 ②3.01×1023个HCl ③13.6 g H2S ④0.2 mol NH3,下列对四种气体的关系表示不正确的是
A. 体积④<①<③<② B. 密度①<④<③<②
C. 质量④<①<③<② D. 氢原子数④<②<③<①
【答案】D
【解析】上述四种气体的物质的量分别为0.3 mol、0.5 mol、0.4 mol、0.2 mol,。A、依M= ![]() Vm可知,体积分别为:6.72 L、11.2L、8.92L、4.48L,故体积④<①<③<②,选项A正确;B、摩尔质量分别为16g/mol、36.5g/mol、34g/mol、17g/mol、,依M=
Vm可知,体积分别为:6.72 L、11.2L、8.92L、4.48L,故体积④<①<③<②,选项A正确;B、摩尔质量分别为16g/mol、36.5g/mol、34g/mol、17g/mol、,依M= ![]() Vm可知,密度①<④<③<②,选项B正确;C、质量4.8 g、18.25 g、13.6 g、3.4 g,故质量④<①<③<②,选项C正确;D、所含氢原子的物质的量分别为1.2 mol、0.5 mol、0.8 mol、0.6 mol,故氢原子数①<③<④<②,选项D不正确。答案选D。
Vm可知,密度①<④<③<②,选项B正确;C、质量4.8 g、18.25 g、13.6 g、3.4 g,故质量④<①<③<②,选项C正确;D、所含氢原子的物质的量分别为1.2 mol、0.5 mol、0.8 mol、0.6 mol,故氢原子数①<③<④<②,选项D不正确。答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碳酸亚铁(FeCO3)是一种重要的工业盐。某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH。
(1)实验探究Ⅰ
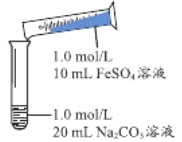
实 验 Ⅰ | 操作 | 现象 |
| 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
①生成FeCO3离子方程式:_________________________________。
②反应过程中可能生成Fe(OH)2的依据是__________________________________。
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有__________________________________。
(2)实验探究Ⅱ
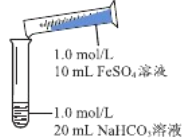
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因______________________________________________。
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多。支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,___________________则结论成立。
(3)实验探究Ⅲ
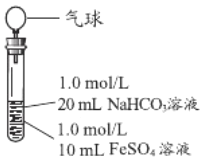
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
实验改进的意图是____________。
(4)综合以上实验,下列说法正确的是__________
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1 L 1.0 mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116 g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3