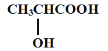题目内容
【题目】世界上最旱发现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问題:
(1)基态Zn原子的核外电子所占据的最高能层符号为_____________,Zn2+基态核外电子排布式为_______________________。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为 _____________(用文字描述);
②SO42-中,中心原子的轨道杂化类型为______________;
③写出一种与SO42-互为等电子体的分子的化学式_____________;
④NH3极易溶于水,除因为它们都是极性分子外,还因为_______________________。
(3)Zn与S所形成化合物晶体的晶胞如图所示。
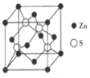
①该化合物的化学式为___________;
②已知该晶体的晶胞参数a=541 pm,其密度为___________g·cm-3(列出计算式即可)。
【答案】 N [Ar]3d10或1s22s22p63s23p63d10 正四面体 sp3 CCl4或SiCl4等 NH3 与 H2O之间可形成分子间氢键 NH3与H2O发生反应 ZnS 4×97 /NA×(541×1010)3
【解析】(1)根据Zn在周期表中的位置是第四周期,第IIB族,含有四个能层及核外电子排布式写法解答;
(2)在[Zn(NH3)4]SO4中,阴离子为SO42,根据价层电子对互斥模型和杂化轨道理论判断空间构型和杂化类型;根据等电子体的原理找出与SO42-互为等电子体粒子;NH3容易与水分子形成分子间氢键;
(3)①根据晶胞晶体中组成粒子的计算方法确定S2-、Zn2+的个数,进一步确定化学式;
②根据晶胞的密度计算公式进行计算。
(1)Zn的核电荷数是30,在Zn在周期表中的位置是第四周期,第IIB族,含有四个能层,分别是K、L、M、N,所以最高能层符号为N;Zn2+基态核外电子排布式为:[Ar]3d10或1s22s22p63s23p63d10;正确答案:N;[Ar]3d10或1s22s22p63s23p63d10;
(2)①根据价层电子对互斥模型, SO42中价电子对数为:(6+4×0+2)÷2=4,价电子对全是成键电子对,所以SO42的空间构型是正四面体,正确答案:正四面体;
②SO42的空间构型是正四面体,根据杂化轨道理论,中心原子S的杂化类型为sp3杂化,正确答案:sp3;
③等电子体是指在原子数相同下,原子的价电子数相同的粒子,通常采用元素上下左右平移法,同时调整电子数来确定等电子体粒子,因此,与SO42互为等电子体的有PO43, ClO4,CCl4 ,SiCl4, SiF4等,符合题干要求是分子的有CCl4 ,SiCl4, SiF4,正确答案为: CCl4 ,SiCl4, SiF4;
④NH3极易溶于水,除因为它们都是极性分子,NH3容易与水分子形成分子间氢键,同时还发生化学反应,其方程式为:NH3+H2O![]() NH3·H2O,正确答案:NH3 与 H2O之间可形成分子间氢键,NH3与H2O发生反应;
NH3·H2O,正确答案:NH3 与 H2O之间可形成分子间氢键,NH3与H2O发生反应;
(3)①对于立方晶胞,顶点粒子占1/8,面心粒子占1/2,晶胞内部原子为整个晶胞所有,则一个ZnS晶胞中,Zn2+个数为8×1/8+6×1/2=4,S2-个数为4,因此该化合物化学式为ZnS,正确答案为:ZnS;
②取1mol晶胞,则有NA个晶胞,已知晶胞参数为a=541pm,则一个晶胞的体积为V0=(541×1010)3cm3,1molZnS晶胞中,有4molZn2+和4molS2-,则一个晶胞的质量为m=4mol×65g/mol+4mol×32g/mol=4×97g,因此晶胞的密度为ρ=m/NAV0=4×97 g/[NA×(541×1010)3]cm3,所以正确答案:4×97 /[NA×(541×1010)3]g·cm-3。

 阅读快车系列答案
阅读快车系列答案【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
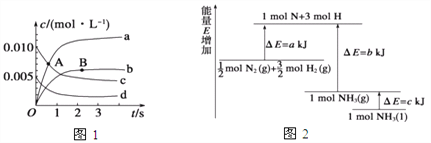
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。