题目内容
【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
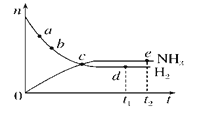
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
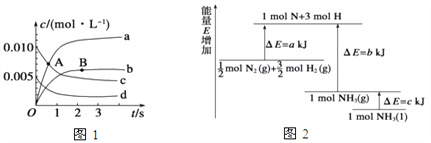
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
【答案】 > > b 15×10-3mol·L-1·s-1 释放 释放 b-a
【解析】试题分析:(1)①A点时反应物减小,反应正向进行;②NO2是生成物,达到平衡时,NO2的物质的量为0.013 mol;根据氧气浓度变化量除以时间计算用O2表示2 s内该反应的速率;(2)根据图像可知,1 mol N和3 mol H的总能量大于1 mol NH3(g)的能量;由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g) 的总能量大于1 mol NH3(g)的总能量;根据图像计算焓变。
mol H2(g) 的总能量大于1 mol NH3(g)的总能量;根据图像计算焓变。
解析:(1)①A点时反应物减小,反应正向进行,所以A点处v正>v逆;A点处NO的浓度大于B,所以A点v正>B点处v正;②NO2是生成物,达到平衡时,NO2的物质的量为0.013 mol,浓度为0.0065 mol·L-1,表示NO2的变化的曲线是b;2s内NO的浓度变化为0.012 mol·L-1,氧气的浓度变化为0.006 mol·L-1÷2,,用O2表示2 s内该反应的速率0.006 mol·L-1÷2÷2s=15×10-3mol·L-1·s-1;(2)根据图像可知,1 mol N和3 mol H的总能量大于1 mol NH3(g)的能量,所以1 mol N和3 mol H生成1 mol NH3(g)是释放能量的过程;由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g) 的总能量大于1 mol NH3(g)的总能量,由
mol H2(g) 的总能量大于1 mol NH3(g)的总能量,由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程释放能量;根据图像,放出的能量为b-akJ。
mol H2(g)生成1 mol NH3(g)过程释放能量;根据图像,放出的能量为b-akJ。

【题目】利用右图所示装置进行下列实验,其中丙中实验现象描述正确的是
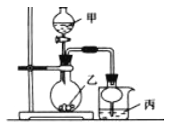
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
C | 稀盐酸 | CaCO3 | BaCI2溶液 | 有白色沉淀生成 |
D | 浓氨水 | CaO | AlCl3 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究_______对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验_____和实验____作对比(填序号)。
(3)将实验1和实验2作对比,t1____t2(填“>”、“<”或“=”)。
II.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
实验步骤:
(1)取5mL0.1mol·L-1KI溶液,再滴加几滴0.1mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂_______(填序号),现象___________,说明此反应存在一定的限度。