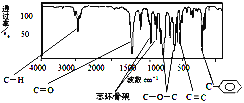
题目内容
【题目】在2L密闭容器内,80℃时反应:2NO(g)+O2(g)![]() 2NO2(g),反应体系中,n(NO)随时间t的变化如下表
2NO2(g),反应体系中,n(NO)随时间t的变化如下表
时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
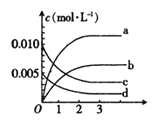
(1)如图表示NO2变化曲线的是________。(填字母)。用O2表示从0~2s内该反应的平均速率v=____________。
(2)能说明该反应已达到平衡状态的是___ _。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
e.等温等容时,充入氦气
f.等温等压时充入氦气
(4)若将2molNO和1molO2充入两个密闭容器中,保持一定温度进行反应:
2NO(g)+O2(g)![]() 2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
(5)如果按物质的量之比为2:1充入NO和O2的混合气体,则达到平衡时NO与O2的转化率 之比为_______。
【答案】(1)b;1.5×10-3 mol·L-1·s-1 (2)bc(3)c(4)>(5)1:1
【解析】
试题分析:(1)由方程式2NO(g)+O2(g)=2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时△c(NO)= (0.02×0.007)/2=0.00625mol/L, 曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化,由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)= 0.006/2=0.003mol/(L.s),根据速率之比等于化学计量数之比,故v(O2)= 1/2 v(NO)= 1/2××0.003mol/(L.s)=0.0015mol/(L.s);
(2)A.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,A错误; B.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,B正确; C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,v逆(NO)=2v正(O2),说明到达平衡,C正确; D.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,D错误;
(3)A.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故A错误; B.适当升高温度,反应速率增大,平衡向逆反应移动,故B错误; C.增大O2的浓度,反应速率增大,平衡向正反应移动,故C正确; D.选择高效的催化剂,增大反应速率,不影响平衡移动,故D错误;
(4)一定温度、恒压条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡,外压等于内压,生成amolNO2
2NO2(g)达到平衡,外压等于内压,生成amolNO2
如果一定温度、恒容条件下,这是一个反应前后气体的物质的量减少的反应反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡后,压强减少,相对第一个反应来说,相当于减压,平衡左移,生成bmolNO2的量减少;
2NO2(g)达到平衡后,压强减少,相对第一个反应来说,相当于减压,平衡左移,生成bmolNO2的量减少;
(5)如果是在等温等容的条件下,反应物的投料之比按照反应物前面的系数进行,则达到平衡时,反应物的转化率之比为1:1;

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案