��Ŀ����
����Ŀ��PCl3��PCl5������Ҫ�Ļ���ԭ�ϡ���PCl3��g����Cl2��g��������������2 L�ܱ�������,��һ�������·���������Ӧ,����10 minʱ�ﵽƽ��:PCl3��g��+Cl2��g�� ![]() PCl5��g�� ��H<0���й���������:
PCl5��g�� ��H<0�����������:
PCl3��g�� | Cl2��g�� | PCl5��g�� | |
��ʼŨ��/��mol/L�� | 2.0 | 1.0 | 0 |
ƽ��Ũ��/��mol/L�� | c1 | c2 | 0.4 |
�����жϲ���ȷ����
A��10 min��,v��Cl2��=0.04 mol/��L��min��
B����������Cl2Ϊ1.2 molʱ,��Ӧ�ﵽƽ��
C�������¶�,��Ӧ��ƽ�ⳣ����С,��ƽ��ʱPCl3��ת���ʱ��
D��ƽ�������2.0 mol PCl3��1.0 mol Cl2,����ͬ�������ٴ�ƽ��ʱ,c��PCl5��<0.2 mol/L
���𰸡�C
��������
���������A���ɱ������ݿ�֪��ƽ��ʱ��c��PCl5��=0.4mol/L�����ݷ���ʽ��֪��c��PCl3��=0.4mol/L��
V��PCl3��= 0.4/10=0.04 molL-1min-1��A��ȷ��B��ƽ��ʱ��c��PCl5��=0.4mol/L�����ݷ���ʽ��֪��c��Cl2��=0.4mol/L����n��Cl2��=0.4mol/L��2L=0.8mol����ƽ��ʱCl2�����ʵ���Ϊ1mol/L��2L-0.8mol=1.2mol����B��ȷ��C�������¶ȣ���Ӧ��ƽ�ⳣ����С��ƽ�����淴Ӧ�ƶ���PCl3ת���ʽ��ͣ���n��С����ƽ��ʱPCl3����n��T1��/ ��n��T2��>1,C������D��ƽ�������2.0mol PCl3��1.0mol Cl2�����ƽ�⣬��ЧΪ��ʼPCl3Ϊ1mol/L��Cl2Ϊ0.5mol/L����ƽ�⣬��Ӧ���Ũ�ȱ�Ϊԭƽ���һ�룬��ԭƽ����ȣ�ѹǿ���ͣ�ƽ�����淴Ӧ�ƶ�����Ӧ��ת���ʽ��ͣ�����ͬ�������ٴ�ƽ��ʱ��c��PCl5����0.2 molL-1��D��ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����2L�ܱ���������80��ʱ��Ӧ:2NO��g��+O2��g��![]() 2NO2��g��,��Ӧ��ϵ����n��NO����ʱ��t�ı仯���±�
2NO2��g��,��Ӧ��ϵ����n��NO����ʱ��t�ı仯���±�
ʱ��t��s�� | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
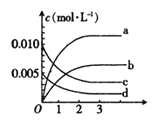
��1����ͼ��ʾNO2�仯���ߵ���________��������ĸ������O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v=____________��
��2����˵���÷�Ӧ�Ѵﵽƽ��״̬����___ _��
a��v��NO2��=2v��O2�� b��������ѹǿ���ֲ���
c��v��NO����=2v��O2���� d���������ܶȱ��ֲ���
��3����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_________��
a����ʱ�����NO2����
b���ʵ������¶�
c������O2��Ũ��
d��ѡ���Ч����
e�����µ���ʱ�����뺤��
f�����µ�ѹʱ���뺤��
��4������2molNO��1molO2���������ܱ������У�����һ���¶Ƚ��з�Ӧ��
2NO��g��+O2��g��![]() 2NO2��g�����ں�ѹ�����´ﵽƽ��ʱ����amolNO2���ں��������´ﵽƽ��ʱ����bmolNO2����a��b�Ĺ�ϵ�ǣ�a_______b���>������<����=����
2NO2��g�����ں�ѹ�����´ﵽƽ��ʱ����amolNO2���ں��������´ﵽƽ��ʱ����bmolNO2����a��b�Ĺ�ϵ�ǣ�a_______b���>������<����=����
��5����������ʵ���֮��Ϊ2��1����NO��O2�Ļ�����壬��ﵽƽ��ʱNO��O2��ת���� ֮��Ϊ_______��