题目内容
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用.
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮.二者在反应过程中放出大量能量,同时生成无毒、无污染的气体.已知室温下,0.1mol燃料完全燃烧释放出的能量为255kJ,请写出该反应的热化学方程式__ ;
(2)298K时,在2L的密闭容器中,发生可逆反应2NO2(g)![]() N2O4(g)△H=-a kJmol-1 (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.
N2O4(g)△H=-a kJmol-1 (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.
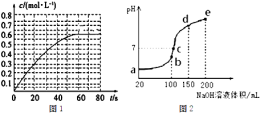
① 298k时,该反应的平衡常数为___________;②若反应在398K进行,某时刻测得n(NO2)=0.6mol,n(N2O4)=1.2mol,则此时V(正)_ _V(逆)(填“>”、“<”或“=”).
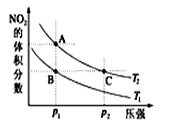
③在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图3所示。下列说法正确的是___________
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B=C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点,①水的电离程度最大的是___________,②其溶液中c(OH-)的数值最接近NH3H2O的电离常数K数值的是___________。
【答案】1)C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(l)△H=-2550 kJ/mol;
(2)①6.67L/mol;②<;③bd;(3)①b ②d
【解析】
试题分析:(1)0.1mol燃料完全燃烧释放出的能量为255kJ,液态偏二甲肼1摩尔(CH3)2N-NH2完全燃烧,放出热量2550 kJ,C2H8N2(l) + 2N2O4(l) ═ 2CO2(g) + 3N2(g) + 4H2O(l) △H =-2550 kJ/mol;
(2)反应为放热反应,升高温度,K值减小;由图式可知C(N2O4)平衡浓度为0.6 molL-1,达平衡时,C(N2O4)=2 C(NO),则C(NO)=0。3 molL-1 带入平衡常数计算公式。Q=0.6/0.32=6.67 =K(298K)>K(398K), 反应反应放热,反应逆向进行,所以V正《 V逆;(3)②a、反应物和生成物全是气态物质,气体的质量不变,容积为2L保持恒定,由ρ= m/V,可知气体的密度为一定值,因此气体的密度保持不变不一定处于平衡状态,a错误; b、混合气体的颜色不变说明NO2的浓度不变,说明反应处于化学平衡状态,b正确; c、当2V(N2O4)正=V(NO2)逆时,正、逆反应速率相等,说明反应处于化学平衡状态,c错误;
(3)①a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、e三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,因此水的电离程度最大的是b点,溶液中c(OH-)的数值最接近NH3H2O的电离常数K数值,②氨水为弱碱,溶液呈碱性,c点溶液呈中性,铵根离子浓度过大,e点溶液碱性过强,一水合氨浓度过大,相对而言d点溶液中铵根离子浓度与一水合氨浓度最接近,溶液中c(OH-)的数值最接近NH3H2O的电离常数K数值,③c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,b点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+)故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);

【题目】在2L密闭容器内,80℃时反应:2NO(g)+O2(g)![]() 2NO2(g),反应体系中,n(NO)随时间t的变化如下表
2NO2(g),反应体系中,n(NO)随时间t的变化如下表
时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
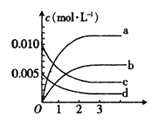
(1)如图表示NO2变化曲线的是________。(填字母)。用O2表示从0~2s内该反应的平均速率v=____________。
(2)能说明该反应已达到平衡状态的是___ _。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
e.等温等容时,充入氦气
f.等温等压时充入氦气
(4)若将2molNO和1molO2充入两个密闭容器中,保持一定温度进行反应:
2NO(g)+O2(g)![]() 2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
(5)如果按物质的量之比为2:1充入NO和O2的混合气体,则达到平衡时NO与O2的转化率 之比为_______。
【题目】雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<O
2CO2(g)+N2(g)△H<O
①反应的速率时间罔像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是 (填对应字母).
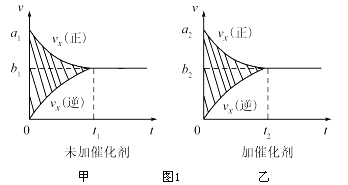
A.a1>a2
B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
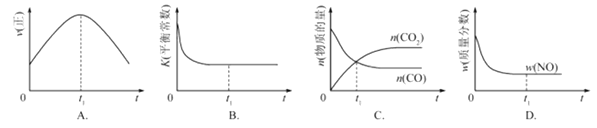
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: .
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是 反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K= .
CO+3H2的平衡常数K= .
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
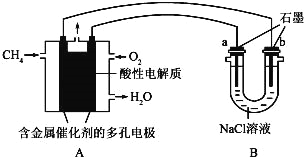
①甲烷燃料电池的负极反应式:
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L.