题目内容
12.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | pH=13 的溶液:Na+、NH4+、SO42-、Cl- | |
| B. | 甲基橙呈黄色的溶液:Na+、K+、ClO-、AlO2- | |
| C. | 0.1 mol/L 的KNO3 溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol.L-1的溶液中:K+、Ba2+、Br-、I- |
分析 A.pH=13 的溶液,显碱性;
B.甲基橙呈黄色的溶液,可能显酸性;
C.离子之间发生氧化还原反应;
D.水电离的c(H+)=1×10-13mol.L-1的溶液,为酸或碱溶液.
解答 解:A.pH=13 的溶液,显碱性,碱性溶液中不能大量存在NH4+,故A错误;
B.甲基橙呈黄色的溶液,可能显酸性,酸性溶液中不能大量存在ClO-、AlO2-,故B错误;
C.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.水电离的c(H+)=1×10-13mol.L-1的溶液,为酸或碱溶液,酸、碱溶液中该组离子之间均不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
2.为完成相应实验,实验器材(规格和数量不限)足够的一项是( )
| 相应实验 | 实验器材(省略夹持装置) | |
| A | 氯化钠溶液的浓缩结晶 | 烧杯、玻璃棒、酒精灯 |
| B | 用盐酸除去硫酸钡中的少量碳酸铜 | 烧杯、漏斗、胶头滴管、滤纸 |
| C | 用浓硫酸配制0.5mol•L-1的溶液 | 烧杯、玻璃棒、胶头滴管、容量瓶 |
| D | 用溴水和CCl4除去NaBr溶液中的少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| A. | A | B. | B | C. | C | D. | D |
20.对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的是( )
| A. | SO42- OH- Cl- K+ | B. | Na+ NO3- OH- Cl- | ||
| C. | K+ Na+ NO3- Cl- | D. | K+ CO32+ H+ Ba2+ |
7.现有1L 0.5mol/L的硫酸钠溶液,有关溶液的叙述正确的是( )
| A. | 取0.5 L溶液,Na+的浓度是0.5 mol/L | |
| B. | 取0.1 L溶液稀释至l L,SO42-离子浓度是0.05 mol/L | |
| C. | 溶质的离子总数是6.02×1023个 | |
| D. | 该溶液是把0.5 mol Na2SO4溶于1 L水中配制而成的 |
4.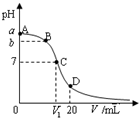 25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
 25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A. | 已知25℃时 0.1 mol•L-1氨水电离度为1.33%,则b<a<1 | |
| B. | 在C点,V1<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) | |
| C. | 在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 在D点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
15.下列离子方程式书写正确的是( )
| A. | 铝与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| B. | 向硫酸铝中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+2H2O+CO32- | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |