题目内容
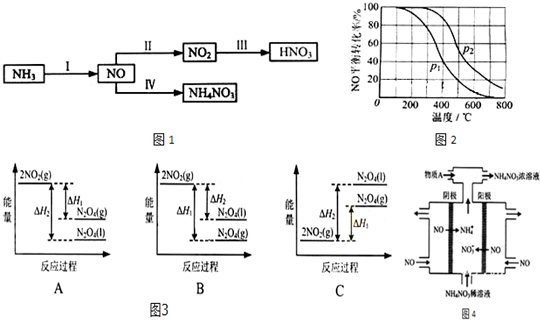
14.无水AlCl3可用有机合成的催化剂,食品膨松剂等.已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾,工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如图1:
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s)?2Fe(s)+3CO(g);
②3CO(g)+Fe2O3(s)?2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$.
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$ 2A1C13+3CO;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+.
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%.现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g.该样品中AlCl3的质量分数为98%.
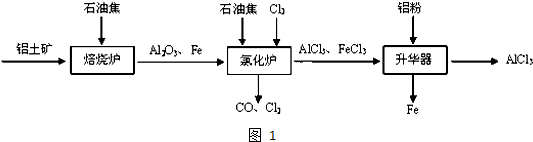
(4)实验室可用下列装置制备无水AlCl3.装置A中的化学反应方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B、C中应盛放的试剂名称分别为饱和食盐水、浓硫酸,F中所盛放试剂是浓硫酸其作用是防止水蒸气进入E装置.
分析 铝土矿加入碳焙烧后加入氧化铝和铁于氯化炉中发生反应氧化铝解饿碳和氯气加热反应生成氯化铝和一氧化碳,AlCl3、FeCl3分别在183℃、315℃时升华,控制温度升华氯化铝得到;
(1)依据反应②化学方程式书写表达式,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(2)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(3)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算.
(4)A中的反应是二氧化锰和浓盐酸加热发生的反应,根据所给的装置图可知,B中的试剂为饱和食盐水是为了除去混有的HCl气体,C中是浓硫酸目的是除去水蒸气;因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以F中试剂为浓硫酸防止水蒸气进入E收集瓶.
解答 解:Ⅰ、(1)②3CO(g)+Fe2O3(s)?2Fe(s)+3CO2(g),反应②的平衡常数的表达式为K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;
故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;
(2)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$2A1C13+3CO,Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,
故答案为:A12O3+3C12+3C$\frac{\underline{\;高温\;}}{\;}$2A1C13+3CO;SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,根据铁原子守恒,令含有杂质FeCl3质量为m,则:
Fe2O3~~~~~2FeCl3
160 325
0.16g m
解得,m=0.325g,
所以AlCl3产品的纯度为$\frac{16.25g-0.325g}{16.25g}$×100%=98%,
故答案为:98%;
(4)A中的反应是二氧化锰和浓盐酸加热发生的反应,化学方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据所给的装置图可知,B中的试剂为饱和食盐水是为了除去混有的HCl气体,C中是浓硫酸目的是除去水蒸气;因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以F中试剂为浓硫酸防止水蒸气进入E收集瓶;
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,饱和食盐水,浓硫酸,浓硫酸,防止水蒸气进入E装置;
点评 本题考查学生对于工艺流程原理的理解、对操作与实验条件控制的理解等,涉及常用化学用语书写、化学计算、分离提纯等,需要学生具备扎实的基础与综合运用能力,难度中等.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | pH=13 的溶液:Na+、NH4+、SO42-、Cl- | |
| B. | 甲基橙呈黄色的溶液:Na+、K+、ClO-、AlO2- | |
| C. | 0.1 mol/L 的KNO3 溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol.L-1的溶液中:K+、Ba2+、Br-、I- |
| A. |  除去甲烷中乙烯 | B. |  制备乙酸乙酯 | ||
| C. |  分离乙酸和水 | D. | 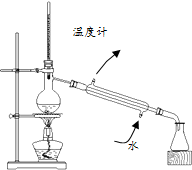 制备蒸馏水 |
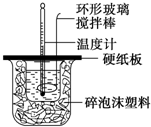 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:

 表示的分子式C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.
表示的分子式C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.