题目内容
4.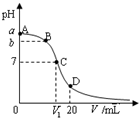 25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
25℃,在20mL 0.1mol•L-1氨水溶液中逐滴加入0.1mol•L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是( )| A. | 已知25℃时 0.1 mol•L-1氨水电离度为1.33%,则b<a<1 | |
| B. | 在C点,V1<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) | |
| C. | 在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 在D点:c(NH4+)+c(NH3•H2O)=c(Cl-) |
分析 A.相同温度下,一水合氨的浓度越大,其电离程度越小,但稀释时溶液中c(OH-)降低导致溶液的pH减小;
B.氯化铵是强酸弱碱盐,其溶液呈酸性,要使混合溶液呈中性,则盐酸体积应该稍微小于氨水体积,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒判断c(NH4+)、c(Cl-)大小,且铵根离子水解程度较小;
C.如果溶液中加入HCl的物质的量较小,则存在c(Cl-)<c(OH-);
D.D点,二者恰好反应生成氯化铵,根据物料守恒判断.
解答 解:A.25℃时 0.1mol/L 氨水电离度为1.33%,0.1mol/L 氨水溶液中氢氧根离子的物质的量浓度=1.33×10-3 mol/L,所以溶液的PH<12,向氨水中加入盐酸时,发生酸碱中和反应导致溶液的pH值降低,所以b<a<12,故A错误;
B.氯化铵是强酸弱碱盐,其溶液呈酸性,要使混合溶液呈中性,则盐酸体积应该稍微小于氨水体积,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=c(Cl-)大小,溶液中铵根离子水解程度较小,所以离子浓度大小顺序是c(NH4+)=c(Cl-)>c(OH-)=c(H+),故B错误;
C.如果溶液中加入HCl的物质的量较小,则存在c(Cl-)<c(OH-),故C错误;
D.D点,二者恰好反应生成氯化铵,根据物料守恒得c(NH4+)+c(NH3•H2O)=c(Cl-),故D正确;
故选D.
点评 本题以酸碱中和反应为载体考查离子浓度大小比较,明确图中曲线上溶质成分及其性质是解本题关键,结合电荷守恒、物料守恒来分析解答,易错选项是C.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
14.室温下,一气态烃与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少50mL,再通过NaOH溶液,体积又减少了40mL,原烃的分子式是( )
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C3H8 |
15.下列对废弃塑料制品的处理方法中,最为恰当的是( )
| A. | 切成碎片后混入土壤中 | |
| B. | 露天焚烧 | |
| C. | 倾倒在偏僻的海滩或海洋中 | |
| D. | 应用化学方法加工成再生塑料制品、防水涂料或燃油等产品 |
12.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=13 的溶液:Na+、NH4+、SO42-、Cl- | |
| B. | 甲基橙呈黄色的溶液:Na+、K+、ClO-、AlO2- | |
| C. | 0.1 mol/L 的KNO3 溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol.L-1的溶液中:K+、Ba2+、Br-、I- |
19.铝可与硝酸钠发生反应:10Al+6NaNO3+6H2O→4Al(OH)3+3N2↑+6NaAlO2,有关叙述正确的是( )
| A. | 该反应的氧化剂是水 | |
| B. | 若反应过程中转移5 mol e-,则生成标准状况下N2的体积为11.2 L | |
| C. | 该反应的氧化产物是N2 | |
| D. | 当消耗1 mol Al时,生成标准状况下N2的体积为22.4 L |
6.下列实验方法或操作能达到实验目的是( )
| A. | 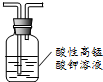 除去甲烷中乙烯 | B. |  制备乙酸乙酯 | ||
| C. |  分离乙酸和水 | D. | 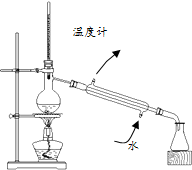 制备蒸馏水 |
7.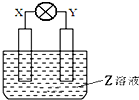 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
 如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是( )| X | Y | Z | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 锌 | 铜 | 硝酸银溶液 |
| D | 碳 | 锌 | 硝酸铜溶液 |
| A. | 锌做负极溶解X电极变轻,错误 | |
| B. | 铁做负极失电子溶解变轻,X电极生成氢气不会变重,错误 | |
| C. | 锌做负极溶解X电极变轻,错误 | |
| D. | 锌做负极失电子发生氧化反应Y棒变轻,碳做正极溶液中铜离子析出使X极变重,正确 |

