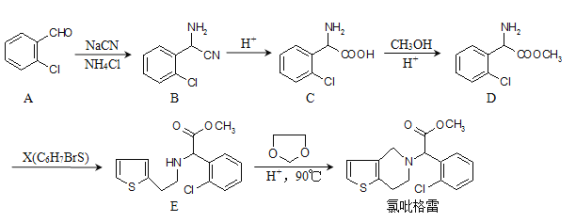
题目内容
【题目】X、Y、Z三种短周期元素原子序数依次喊小,原子半径的大小关系为:r(Y)>r(X)>r(Z), 三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
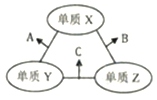
A. X元素位于ⅥA族 B. A难溶于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
【答案】C
【解析】B和C均为10电子分子,考虑为氢化物,由转化关系可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,原子半径Y>X,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素,由转化关系,单质X、Y反应生成A,单质Y、Z生成B,则Y应为氮元素、X应为氧元素,则A为NO、B为H2O、C为NH3,验证符合转化关系。A.X为氧元素,处于ⅥA族,故A正确;B.NO不溶于水,故B正确;C.氨气与NO可以发生反应生成氮气与水,故C错误;D.常温下,水为液体,氨气为气态,水的沸点更高,故D正确;故选C。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目