题目内容
下列对于25℃时pH为12的氨水,叙述正确的是( )
| A、由水电离出的c(OH-)=1.0×10-2mol?L-1 |
| B、c(NH4+)+c(NH3?H2O)=1.0×10-12mol?L-1 |
| C、与等体积、pH=2的盐酸混合后所得的溶液中:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| D、加入一定量pH=2的醋酸溶液混合后所得的溶液中:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+) |
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、pH=12的氨水,说明溶液中氢离子的浓度为10-12mol?L-1,而水电离出的氢离子与氢氧根离子的溶液始终相等;
B、pH=12的氨水只有部分氨水电离,主要仍然是一水合铵,pH为12的氨水,说明氢氧根离子浓度为10-2mol?L-1,所以原氨水的浓度远大于10-2mol?L-1,根据氮守恒可知c(NH4+)+c(NH3?H2O)>1.0×10-12mol?L-1;
C、与等体积、pH=2的盐酸混合得到氨水和氯化铵溶液的混合物,溶液呈碱性,电离是微弱的;
D、加入一定量pH=2的醋酸溶液混合后所得的溶液中,电荷守恒c(CH3COO-)+c(OH-)=c(NH4+)+c(H+).
B、pH=12的氨水只有部分氨水电离,主要仍然是一水合铵,pH为12的氨水,说明氢氧根离子浓度为10-2mol?L-1,所以原氨水的浓度远大于10-2mol?L-1,根据氮守恒可知c(NH4+)+c(NH3?H2O)>1.0×10-12mol?L-1;
C、与等体积、pH=2的盐酸混合得到氨水和氯化铵溶液的混合物,溶液呈碱性,电离是微弱的;
D、加入一定量pH=2的醋酸溶液混合后所得的溶液中,电荷守恒c(CH3COO-)+c(OH-)=c(NH4+)+c(H+).
解答:
解:A、pH=12的氨水,说明溶液中氢离子的浓度为10-12mol?L-1,而水电离出的氢离子与氢氧根离子的溶液始终相等,故A错误;
B、pH=12的氨水只有部分氨水电离,主要仍然是一水合铵,pH为12的氨水,说明氢氧根离子浓度为10-2mol?L-1,所以原氨水的浓度远大于10-2mol?L-1,根据氮守恒可知c(NH4+)+c(NH3?H2O)>1.0×10-12mol?L-1,故B错误;
C、与等体积、pH=2的盐酸混合得到氨水和氯化铵溶液的混合物,溶液呈碱性,电离是微弱的,所以离子浓度的大小顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D、加入一定量pH=2的醋酸溶液混合后所得的溶液中,电荷守恒c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),故D正确;
故选D.
B、pH=12的氨水只有部分氨水电离,主要仍然是一水合铵,pH为12的氨水,说明氢氧根离子浓度为10-2mol?L-1,所以原氨水的浓度远大于10-2mol?L-1,根据氮守恒可知c(NH4+)+c(NH3?H2O)>1.0×10-12mol?L-1,故B错误;
C、与等体积、pH=2的盐酸混合得到氨水和氯化铵溶液的混合物,溶液呈碱性,电离是微弱的,所以离子浓度的大小顺序为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D、加入一定量pH=2的醋酸溶液混合后所得的溶液中,电荷守恒c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),故D正确;
故选D.
点评:本题考查弱电解质在水溶液中的电离平衡,pH相同的强碱和弱碱浓度大小的比较和电荷守恒的应用.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
由a g乙酸、b g葡萄糖,c g尿素[CO(NH2)2]组成的混合物150g,在一定条件下完全燃烧生成90g水,则a,b,c的比值是( )
| A、1:1:1 | B、1:3:1 |
| C、任意比 | D、无法计算 |
下列叙述正确的是( )
| A、通式相同的不同物质一定属于同系物 |
| B、同系物的物理性质不同,化学性质相似 |
| C、同系物的物理性质相似,化学性质不同 |
| D、同系物的物理性质相似,化学性质也相似 |
下列有关说法中,错误的是( )
| A、乙烯和苯都能与溴水反应 |
B、CaC2的电子式为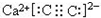 |
| C、常用质谱法进行有机物相对分子质量的测定 |
| D、乙醇的结构简式为:C2H5OH |
下列电子式的书写正确的是( )
A、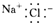 |
B、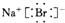 |
C、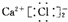 |
D、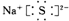 |
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
⑤碱性(同浓度)Ca(OH)2>Ba(OH)2 ⑥与同浓度稀硫酸反应的速率:Mg>Al
⑦氧化性Br2>F2 ⑧熔点:Si3N4>NaCl>SiI4 ⑨沸点:NH3>PH3>AsH3.
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
⑤碱性(同浓度)Ca(OH)2>Ba(OH)2 ⑥与同浓度稀硫酸反应的速率:Mg>Al
⑦氧化性Br2>F2 ⑧熔点:Si3N4>NaCl>SiI4 ⑨沸点:NH3>PH3>AsH3.
| A、①③⑦⑨ | B、②④⑥⑧ |
| C、①④⑥⑨ | D、②③⑤⑦ |
下列有关物质结构中的说法正确的是( )
| A、78 g Na2O2晶体中所含阴阳离子个数为4NA |
| B、1.5 g CH3+中含有的电子数为NA |
| C、3.4 g氨气中含有0.6NA个N-H键 |
| D、PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
为说明氯比硫的非金属性强,下列事实可作依据的是( )
| A、HCl的溶解性强于H2S |
| B、氯的最高价为+7价 |
| C、H2S中的S2-能被Cl2氧化 |
| D、HClO的氧化性强于H2SO4 |