题目内容
【题目】实验室制乙烯时,产生的气体能使溴水褪色,甲、乙同学用下列实验验证。
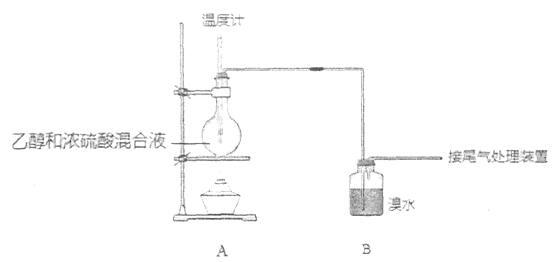
(气密性已检验,部分夹持装置略)。实验操作和现象为:
操作 | 现象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)烧瓶内产生乙烯的化学方程式是________。
(2)溶液“渐渐变黑”,说明浓硫酸具有________性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是________。
②乙根据现象III认为产生了SO2,在B中与SO2反应使溶液褪色的物质是________。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
设计 | 现象 | |
甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | 溴水褪色 |
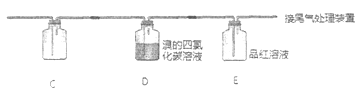
乙 | 与A连接的装置如下:
| D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
a. 根据甲的设计,洗气瓶中盛放的试剂是________。
b. 根据乙的设计,C中盛放的试剂是________。
c. 能证明确实是SO2使E中溶液褪色的实验是________。
d. 乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是________。
(4)上述实验得到的结论是________。
【答案】 CH3CH2OH ![]() CH2=CH2↑+H2O 脱水性 CH2=CH2+Br2→CH2Br-CH2Br H2O、Br2 NaOH溶液 浓硫酸 加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2 SO2+2H2O+Br2=4H++2Br-+SO42-、SO42-+Ba2+=BaSO4↓或SO2+2H2O+Br2+Ba2+==4H++2Br-+BaSO4↓ 乙烯能使Br2的四氯化碳溶液褪色,干燥的SO2不能使Br2的四氯化碳溶液褪色
CH2=CH2↑+H2O 脱水性 CH2=CH2+Br2→CH2Br-CH2Br H2O、Br2 NaOH溶液 浓硫酸 加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2 SO2+2H2O+Br2=4H++2Br-+SO42-、SO42-+Ba2+=BaSO4↓或SO2+2H2O+Br2+Ba2+==4H++2Br-+BaSO4↓ 乙烯能使Br2的四氯化碳溶液褪色,干燥的SO2不能使Br2的四氯化碳溶液褪色
【解析】(1)乙醇能在一定的条件下发生消去反应生成乙烯。
(2)浓硫酸具有脱水性、吸水性和强氧化性。
(3) ①乙烯可与溴水发生加成反应;②溴单质可以和二氧化硫发生氧化还原反应; ③a、氢氧化钠可以和二氧化硫发生反应b、浓硫酸具有吸水性,可以做干燥剂,并能将乙烯氧化;c、溴单质可以和二氧化硫发生氧化还原反应,硫酸根离子和钡离子反应会生成白色沉淀。
(4)乙烯能使溴的四氯化碳溶液褪色,二氧化硫和溴单质的反应必须在水溶液中进行。
(1)乙醇能在浓硫酸并加热的条件下发生消去反应生成乙烯,原理方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O;正确答案:CH3CH2OH
CH2=CH2↑+H2O;正确答案:CH3CH2OH ![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
(2)浓硫酸具有脱水性,能使乙醇脱水碳化,溶液“渐渐变黑”;正确答案:脱水性。
(3)①乙烯与溴发生加成反应,溴水褪色,反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;正确答案:CH2=CH2+Br2→CH2Br-CH2Br。
②乙根据现象Ⅲ认为产生了SO2,在B中溴单质可以和二氧化硫发生氧化还原反应;正确答案: H2O、Br2 。
③a、根据甲的设计,洗气瓶中盛放的试剂是氢氧化钠,可以和二氧化硫反应,吸收二氧化硫,排除二氧化硫的干扰;正确答案:NaOH溶液。
b、根据乙的设计,C中盛放的试剂是,浓硫酸具有吸水性,可以做干燥剂,可将乙烯氧化为二氧化碳,排除在检验二氧化硫时乙烯的干扰;正确答案:浓硫酸。
c. 能证明确实是SO2使E中溶液褪色的实验是:加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2;正确答案:加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2。
d. 溴单质可以和二氧化硫发生氧化还原反应,生成硫酸根离子和溴离子,硫酸根离子和钡离子反应会生成白色沉淀,相关反应的离子方程式为:SO2+2H2O+Br2=4H++2Br-+SO42-、SO42-+Ba2+=BaSO4↓或SO2+2H2O+Br2+Ba2+==4H++2Br-+BaSO4↓;正确答案:SO2+2H2O+Br2=4H++2Br-+SO42-、SO42-+Ba2+=BaSO4↓或SO2+2H2O+Br2+Ba2+==4H++2Br-+BaSO4↓ 。
(4)根据实验过程可以知道:乙烯能使溴的四氯化碳溶液褪色,二氧化硫和溴单质的反应必须在水溶液中进行;正确答案:乙烯能使Br2的四氯化碳溶液褪色,干燥的SO2不能使Br2的四氯化碳溶液褪色。