题目内容
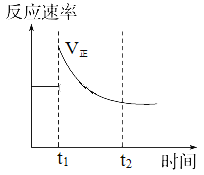
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
【答案】B
【解析】
在相同温度下,Ag2SO4的溶度积为定值,随着浓度SO42-的增大,Ag+浓度逐渐减小,位于曲线的点b、c为平衡状态,即溶液达到饱和,a为不饱和状态,以此解答该题。
A.在相同温度下,Kap相同,所以A选项是正确的;
B.蒸发溶液,Ag+浓度和SO42-浓度都增大,不可能为a点达到b点,故B错误;
C.由图象可以知道,Ag2SO4的溶度积常数Ksp=(0.02)2×0.04=1.6×10-5,所以C选项是正确的;
D.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(Ag+)=0.01moL/L,c(SO42-)=0.1mol/L,则(0.01)2×0.1=1×10-5<1.6×10-5,没有沉淀生成,所以D选项是正确的。
答案选B。

【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作现象 | 实验结论 |
A | 像某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含有Br2 |
B | 像某溶液与稀盐酸反应产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液中一定含有CO32- |
C | 加热盛有少量NH4HCO3 固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3呈碱性 |
D | 向久置的Na2SO3 溶液中加入足量BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,沉淀部分溶解 | Na2SO3 部分被氧化 |
A. AB. BC. CD. D