题目内容
【题目】如图表示可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是
2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是
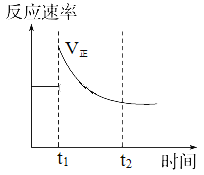
A. t1时降低了温度,平衡向正反应方向移动
B. t1时增大了压强,平衡向正反应方向移动
C. t1时增大了N2的浓度同时减小了NH3的浓度,平衡向正反应方向移动
D. t1时可能使用了催化剂
【答案】C
【解析】
由图可知t1时正反应速率变大,而逆反应速率减少,达到新平衡时速率比原速率小,不是压强、温度和催化剂的变化,因为压强、温度和催化剂变化,正、逆反应速率变化趋势相同,所以t1时增大了A的浓度正反应速率加快,同时减小了C的浓度,逆反应速率减小,正反应速率大于逆反应速率,所以平衡向正反应方向移动,故合理选项是C。

【题目】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1) B元素符号为____,A与C以原子个数比为1:1形成的化合物的电子式为___,用电子式表示C与E形成化合物的过程____, D形成的简单离子的结构示意图为____。
(2) F的氢化物是由____(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式____。
(3) 非金属性D____E(填大于或小于),请从原子结构的角度解释原因:__。
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1 mol/L | 1 mol/L |
A. 向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B. 为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C. ①、③混合后发生反应:Mg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3·H2O(aq)
Mg2+(aq)+2NH3·H2O(aq)
D. 向①中加入②,H+与OH—反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动