题目内容
已知可逆反应:M(g)+N(g)═2P(g)+Q(g)正反应为吸热反应;请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)其它条件不变,反应温度升高,M的转化率
(3)其它条件不变,在反应的密闭容器中通入氩气(不参加反应).达到平衡后,P的百分含量将
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.(2)其它条件不变,反应温度升高,M的转化率
增大
增大
(填“增大“‘减小”或“不变”).(3)其它条件不变,在反应的密闭容器中通入氩气(不参加反应).达到平衡后,P的百分含量将
不变
不变
(填“增大”“减小”或“不变”).分析:(1)根据M的转化率为60%计算出M的浓度变化量,利用浓度变化量之比等于化学计量数之比求出N的浓度变化量,再根据转化率定义计算;
(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大;
(3)其它条件不变,在反应的密闭容器中通入氩气,不影响平衡,P的百分含量不变.
(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大;
(3)其它条件不变,在反应的密闭容器中通入氩气,不影响平衡,P的百分含量不变.
解答:解:(1)△c(M)=60%×1mol?L-1=0.6mol?L-1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6mol?L-1,故此时N的转化率
×100%=25%.
故答案为:25%
(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大.
故答案为:增大
(3)其它条件不变,在反应的密闭容器中通入氩气,不影响平衡,P的百分含量不变.
故答案为:不变
| 0.6mol?L-1 |
| 2.4mol?L-1 |
故答案为:25%
(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大.
故答案为:增大
(3)其它条件不变,在反应的密闭容器中通入氩气,不影响平衡,P的百分含量不变.
故答案为:不变
点评:考查化学平衡计算及影响因素,难度不大,注意稀有气体的通入,看是否引起浓度变化,若浓度不变,不影响平衡;若引起浓度变化,根据情况利用压强分析.

练习册系列答案
相关题目
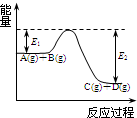 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题: