题目内容
已知可逆反应:M(g)+N(g)?P(g)+Q(g);△H>0,请回答下列问题:
Ⅰ(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)若反应温度升高,M的转化率
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=bmol?L-1,达到平衡后,M的转化率为
ⅡN2O2-是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是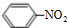
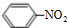 .
.
(2)2N2O5(g)→4NO2(g)+O2(g);△H>0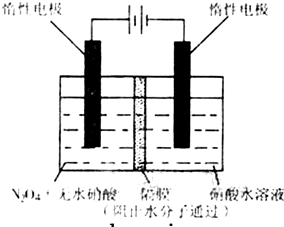
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将
②下表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为
③在T3温度下,反应1 000s时测得NO2的浓度为4.98mol?L-1,则T2
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的
Ⅰ(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.(2)若反应温度升高,M的转化率
增大
增大
(填“增大”“减小”或“不变”).(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
6
6
.(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=bmol?L-1,达到平衡后,M的转化率为
41.4%
41.4%
.ⅡN2O2-是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
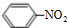
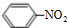
(2)2N2O5(g)→4NO2(g)+O2(g);△H>0

①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将
不变
不变
(填“增大”、“减小”、“不变”).②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
0.00296 mol?L-1?s-1
0.00296 mol?L-1?s-1
.③在T3温度下,反应1 000s时测得NO2的浓度为4.98mol?L-1,则T2
<
<
T1.(3)如图所示装置可用于制备N2O5,则N2O5在电解池的
阳极
阳极
区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+
N2O4+2HNO3-2e-=2N2O5+2H+
.分析:Ⅰ(1)根据M的转化率计算△c(M),利用浓度变化量之比等于物质的量之比计算△c(N),N的转化率=
×100%;
(2)该反应正反应是吸热反应,升高温度平衡向正反应移动,M的转化率增大;
(3)根据(1)中数据计算平衡常数,根据平衡时P的浓度,利用浓度变化量之比等于物质的量之比计算△c(N),利于三段式表示出平衡时各组分的浓度,代入平衡常数列方程,计算a的值;
(4)设M的转化率为x,则M的浓度变化量为bxmol/L,利于三段式表示出平衡时各组分的浓度,代入平衡常数列方程计算x的值;
Ⅱ(1)硝基苯的结构简式是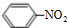 ;
;
(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,根据v=
计算N2O5的分解速率;
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
×4.98mol?L-1=2.51mol/L,高于在T1温度下,反应1000s时测得NO2的浓度,说明该温度下反应正向进行程度小;
(3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成.
| △c(N) |
| N的起始浓度 |
(2)该反应正反应是吸热反应,升高温度平衡向正反应移动,M的转化率增大;
(3)根据(1)中数据计算平衡常数,根据平衡时P的浓度,利用浓度变化量之比等于物质的量之比计算△c(N),利于三段式表示出平衡时各组分的浓度,代入平衡常数列方程,计算a的值;
(4)设M的转化率为x,则M的浓度变化量为bxmol/L,利于三段式表示出平衡时各组分的浓度,代入平衡常数列方程计算x的值;
Ⅱ(1)硝基苯的结构简式是
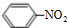 ;
;(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,根据v=
| △c |
| △t |
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
| 1 |
| 2 |
(3)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成.
解答:解:Ⅰ(1)反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,则△c(M)=1mol?L-1×60%=0.6mol/L,浓度变化量之比等于物质的量之比,所以△c(N)=△c(M)=0.6mol/L,N的转化率为
×100%=25%,故答案为:25%;
(2)该反应正反应是吸热反应,升高温度平衡向正反应移动,M的转化率增大,故答案为:增大;
(3)平衡时则△c(M)=1mol?L-1×60%=0.6mol/L,则:
M(g)+N(g)?P(g)+Q(g);
开始(mol/L):1 2.4 0 0
变化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
故该温度下平衡常数k=
=0.5
反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,则:
M(g)+N(g)?P(g)+Q(g);
开始(mol/L):4 a 0 0
变化(mol/L):2 2 2 2
平衡(mol/L):2 a-2 2 2
所以
=0.5,解得:a=6,
故答案为:6;
(4)反应物的起始浓度为:c(M)=c(N)=bmol?L-1,设M的转化率为x,则M的浓度变化量为bxmol/L,则:
M(g)+N(g)?P(g)+Q(g);
开始(mol/L):b b 0 0
变化(mol/L):bx bx bx bx
平衡(mol/L):b-bx b-bx bx bx
所以
=0.5,解得x=41.4%,
故答案为:41.4%;
Ⅱ(1)硝基苯的结构简式是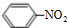 ,故答案为:
,故答案为: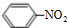 ;
;
(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,故答案为:不变;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率为
=0.00296 mol?L-1?s-1,故答案为:0.00296 mol?L-1?s-1;
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
×4.98mol?L-1=2.51mol/L,高于在T1温度下,反应1000s时测得NO2的浓度,说明该温度下反应正向进行程度小,故温度T2<T1,
故答案为:<;
(3)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极,N2O4+2HNO3-2e-=2N2O5+2H+.
| 0.6mol/L |
| 2.4mol/L |
(2)该反应正反应是吸热反应,升高温度平衡向正反应移动,M的转化率增大,故答案为:增大;
(3)平衡时则△c(M)=1mol?L-1×60%=0.6mol/L,则:
M(g)+N(g)?P(g)+Q(g);
开始(mol/L):1 2.4 0 0
变化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
故该温度下平衡常数k=
| 0.6×0.6 |
| 0.4×1.8 |
反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,则:
M(g)+N(g)?P(g)+Q(g);
开始(mol/L):4 a 0 0
变化(mol/L):2 2 2 2
平衡(mol/L):2 a-2 2 2
所以
| 2×2 |
| 2×(a-2) |
故答案为:6;
(4)反应物的起始浓度为:c(M)=c(N)=bmol?L-1,设M的转化率为x,则M的浓度变化量为bxmol/L,则:
M(g)+N(g)?P(g)+Q(g);
开始(mol/L):b b 0 0
变化(mol/L):bx bx bx bx
平衡(mol/L):b-bx b-bx bx bx
所以
| bx×bx |
| (b-bx)×(b-bx) |
故答案为:41.4%;
Ⅱ(1)硝基苯的结构简式是
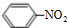 ,故答案为:
,故答案为: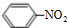 ;
;(2)①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,故答案为:不变;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率为
| 1.48mol/L |
| 500s |
③由表中数据可知,在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则此时N2O5的浓度为5mol/L-
| 1 |
| 2 |
故答案为:<;
(3)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极,N2O4+2HNO3-2e-=2N2O5+2H+.
点评:本题为拼合型,涉及化学反应速率计算、化学平衡移动与计算、平衡常数的计算与运用、电解原理等知识点,题量大,计算量较大,是对学生心理素质的考验,题目难度较高,注意掌握平衡常数在化学平衡计算的运用.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
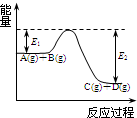 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题: