题目内容
 (1)反应A(g)+B(g)
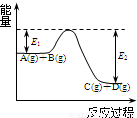
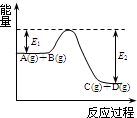
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.①该反应是
放热
放热
反应(填“吸热”“放热”);②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
减小
减小
,E2减小
减小
(填“增大”“减小”“不变”);(2)已知可逆反应:M(g)+N(g)
 P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
BCF
BCF
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.③若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
6
6
mol?L-1.分析:(1)①根据反应物总能量和生成物总能量的关系判断反应热;
②加入催化剂能降低物质的活化能;
(2)①增大M的转化率应使平衡向正反应方向移动;
②根据方程式计算;
③利用平衡常数计算.
②加入催化剂能降低物质的活化能;
(2)①增大M的转化率应使平衡向正反应方向移动;
②根据方程式计算;
③利用平衡常数计算.
解答:解:(1)①由图象可以看出反应物总能量大于生成物的总能量,则该反应的正反应为放热反应,故答案为:放热;
②加入催化剂能降低物质的活化能,则E1和E2都减小,故答案为:减小;减小;
(2)①A、加入一定量M,虽然平衡向正反应方向移动,但加入的多,转化的少,M的转化率减小,故A错误;
B、加入一定量N,平衡向正反应方向移动,M的转化率增大,故B正确;
C、该反应的正反应为吸热反应,温度升高,平衡向正反应方向移动,M的转化率增大,故C正确;
D、缩小容器体积,压强增大,平衡不移动,转化率不变,故D错误;
E、加入某物质作催化剂,平衡不移动,转化率不变,故E错误;
F、分离出一定量P,平衡向正反应方向移动,M的转化率增大,故F正确,
故答案为:B、C、F;
②达到平衡后,M的转化率为60%,则M的转化的物质的量浓度为1mol/L×60%=0.6mol/L,根据反应的方程式可知N的浓度变化量为0.6mol/L,所以N的转化率为:
×100%=25%,故答案为:25%;
③由②可知该温度下的平衡常数为:
=
,
反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,则生成的Q为2mol?L-1,
平衡时c(M)=2mol?L-1,c(N)=(a-2)mol?L-1;
温度不变,则平衡常数不变,则
=
,a=6,故答案为:6.
②加入催化剂能降低物质的活化能,则E1和E2都减小,故答案为:减小;减小;
(2)①A、加入一定量M,虽然平衡向正反应方向移动,但加入的多,转化的少,M的转化率减小,故A错误;
B、加入一定量N,平衡向正反应方向移动,M的转化率增大,故B正确;
C、该反应的正反应为吸热反应,温度升高,平衡向正反应方向移动,M的转化率增大,故C正确;
D、缩小容器体积,压强增大,平衡不移动,转化率不变,故D错误;
E、加入某物质作催化剂,平衡不移动,转化率不变,故E错误;
F、分离出一定量P,平衡向正反应方向移动,M的转化率增大,故F正确,
故答案为:B、C、F;
②达到平衡后,M的转化率为60%,则M的转化的物质的量浓度为1mol/L×60%=0.6mol/L,根据反应的方程式可知N的浓度变化量为0.6mol/L,所以N的转化率为:
| 0.6mol/L |
| 2.4mol/L |
③由②可知该温度下的平衡常数为:
| 0.6×0.6 |
| 0.4×1.8 |
| 1 |
| 2 |
反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,则生成的Q为2mol?L-1,
平衡时c(M)=2mol?L-1,c(N)=(a-2)mol?L-1;
温度不变,则平衡常数不变,则
| 2×2 |
| 2×(a-2) |
| 1 |
| 2 |
点评:本题考查化学平衡的有关计算,题目难度中等,注意掌握影响平衡移动的因素,把握平衡常数的计算和应用.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
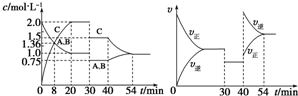 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示,下列说法中正确的是( )
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示,下列说法中正确的是( )| A、30~40min该反应使用了催化剂 | B、反应方程式中的x=1,正反应为吸热反应 | C、30min时降低压强,40min时升高温度 | D、8min时反应第一次达到平衡 |

 C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题: