题目内容
已知可逆反应:M(g)+N(g)?P(g)+Q(g);△H<0.请回答下列问题:
(1)在此温度下,反应物的起始浓度分别为:c(M)=1mol/L,c(N)=2mol/L;达平衡后,M的转化率为50%,求N的转化率
(2)若升高温度,M的转化率
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=3mol/L,c(N)=a mol/L,达平衡后,c(P)=2mol/L.求a=
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L.达平衡后 M的转化率为
(1)在此温度下,反应物的起始浓度分别为:c(M)=1mol/L,c(N)=2mol/L;达平衡后,M的转化率为50%,求N的转化率
25%
25%
;(2)若升高温度,M的转化率
减小
减小
(填增大 减小 不变)(3)若反应温度不变,反应物的起始浓度分别为:c(M)=3mol/L,c(N)=a mol/L,达平衡后,c(P)=2mol/L.求a=
14
14
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L.达平衡后 M的转化率为
36.6%
36.6%
.分析:(1)根据方程式可知反应消耗的N和M的物质的量相等进行计算;
(2)根据温度对平衡的影响分析,反应放热,升高温度平衡左移;
(3)由于温度不变,则平衡常数不变,与(1)相同,以此计算;
(4)设平衡时转化的M为xmol,由于温度不变,则平衡常数不变,与(1)相同,以此计算.
(2)根据温度对平衡的影响分析,反应放热,升高温度平衡左移;
(3)由于温度不变,则平衡常数不变,与(1)相同,以此计算;
(4)设平衡时转化的M为xmol,由于温度不变,则平衡常数不变,与(1)相同,以此计算.
解答:解:(1)M转化的浓度为1mol/L×50%=0.5moL/L,则有:
M(g)+N(g) P(g)+Q(g);△H<0
P(g)+Q(g);△H<0
初始:1mol/L 2mol/L 0 0
转化:0.5mol/L 0.5mol/L 0.5mol/L 0.5mol/L
平衡:0.5mol/L 1.5mol/L 0.5mol/L 0.5mol/L
N的转化率=
×100%=25%,
故答案为:25%;
(2)反应放热,升高温度平衡左移,则M的转化率减小,故答案为:减小;
(3)根据相同温度时平衡常数不变求解,
M(g)+N(g) P(g)+Q(g);△H<0
P(g)+Q(g);△H<0
初始:3mol/L amol/L 0 0
转化:2mol/L 2mol/L 2mol/L 2mol/L
平衡:1 mol/L (a-2)mol/L 2mol/L 2mol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:
=
=
,解之得a=14,故答案为:14;
(4)设平衡时转化的M为xmol,
M(g)+N(g) P(g)+Q(g);△H<0
P(g)+Q(g);△H<0
初始:bmol/L bmol/L 0 0
转化:xmol/L xmol/L xmol/L xmol/L
平衡:(b-x) mol/L (b-x)mol/L xmol/L xmol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:
=
,则
=
=0.366,
故答案为:36.6%.
M(g)+N(g)
 P(g)+Q(g);△H<0
P(g)+Q(g);△H<0初始:1mol/L 2mol/L 0 0
转化:0.5mol/L 0.5mol/L 0.5mol/L 0.5mol/L
平衡:0.5mol/L 1.5mol/L 0.5mol/L 0.5mol/L
N的转化率=
| 0.5mol/L |
| 2mol/L |
故答案为:25%;
(2)反应放热,升高温度平衡左移,则M的转化率减小,故答案为:减小;
(3)根据相同温度时平衡常数不变求解,
M(g)+N(g)
 P(g)+Q(g);△H<0
P(g)+Q(g);△H<0初始:3mol/L amol/L 0 0
转化:2mol/L 2mol/L 2mol/L 2mol/L
平衡:1 mol/L (a-2)mol/L 2mol/L 2mol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:
| 2×2 |
| 1×(a-2) |
| 0.5×0.5 |
| 0.5×1.5 |
| 1 |
| 3 |
(4)设平衡时转化的M为xmol,
M(g)+N(g)
 P(g)+Q(g);△H<0
P(g)+Q(g);△H<0初始:bmol/L bmol/L 0 0
转化:xmol/L xmol/L xmol/L xmol/L
平衡:(b-x) mol/L (b-x)mol/L xmol/L xmol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:
| x2 |
| (b-x)2 |
| 1 |
| 3 |
| x |
| b |
| 1 | ||
1+
|
故答案为:36.6%.
点评:本题考查化学平衡的计算,题目难度不大,做题时注意利用平衡常数计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
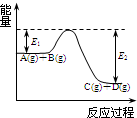 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题: