题目内容
20.下列检验铵盐的方法中,正确的是( )| A. | 加入氢氧化钠溶液,加热试管,再滴入酚酞试液 | |
| B. | 加入氢氧化钠溶液,加热试管,并用湿润的红色石蕊试纸接近试管口上方 | |
| C. | 加热试管,并用湿润的红色石蕊试纸接近试管口上方 | |
| D. | 加水溶解,再用红色石蕊试纸检验其溶液 |
分析 检验铵盐溶液的方法是:铵盐和氢氧化钠在加热条件下生成氨气,氨气能使湿润红色石蕊试纸会变蓝色,由原子守恒来判断为铵盐.
A、氢氧化钠溶液是强碱,也可以使酚酞变红色;
B、加入氢氧化钠溶液加热,检验生成的氨气,可以证明是否含有铵盐;
C、铵盐中如氯化铵受热分解生成的氨气和氯化氢会重新生成氯化铵;
D、氯化铵溶于水,溶液中铵根离子水解显酸性,但显酸性的不一定是铵盐;
解答 解:A.加强碱氢氧化钠溶液后加热,再滴入无色酚酞试液,因为强碱溶液呈碱性,不能确定是否有铵根离子,故A错误;
B.加入氢氧化钠溶液,加热试管,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,证明产生的气体是氨气,则该盐中含有铵根离子,这是检验铵盐的方法,故B正确;
C、直接加热铵盐晶体虽然也可分解产生氨气,但同时会生成其他气体,混合气体及水蒸气在到达试管口之前即又冷却化合成为原铵盐晶体附着在试管壁上,如氯化铵受热分解生成的氨气和氯化氢会重新生成氯化铵,故无法使湿润红色石蕊试纸变蓝,故C错误;
D.铵盐和水混合不会产生氨气,用红色石蕊试纸检验溶液显示红色,是因为铵根离子水解显示酸性,但是显酸性的溶液不一定是铵盐,故D错误;
故选B.
点评 本题主要考查了铵盐溶液的检验方法,难度不大,明确铵盐的性质是解本题关键.

练习册系列答案
相关题目
10.下列关于有机物的叙述正确的是( )
| A. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| B. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同种物质 | |
| D. | 羧基、醛基、羟基、乙基都属于有机物的官能团 |
11.下列反应,属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr | |
| C. | CH2═CH2+Br2-→CH2Br-CH2Br | |
| D. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O |
8.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
| A. | 2H++2e-═H2↑ | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe-3e-═Fe3+ |
15.关于硫的叙述正确的是( )
| A. | 硫的非金属性较强,所以只以化合态存在于自然界 | |
| B. | 分离黑火药(S、C、KNO3)的成分需要使用二硫化碳、水及过滤操作 | |
| C. | 硫与金属或非金属反应时均做氧化剂 | |
| D. | 1.6克硫与6.4克铜反应能得到8.0克纯净硫化物 |
5.下列递变情况中,正确的是( )
| A. | Na、Mg、Al原子的最外层电子数依次减少 | |
| B. | N、O、F元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Li、Na、K的金属性依次减弱 |
12.在下列物质中,既含离子键又含共价键的是( )
| A. | MgCl2 | B. | NaOH | C. | H2O | D. | Cl2 |
14.用化学试剂鉴别下列各组物质,填写所用试剂和相应的实验现象.
| 鉴别对象 | 所用试剂 | 实验现象 |
| 苯和苯酚 | 加入FeCl3溶液 | 苯无现象,苯酚溶液呈紫色 |
| 苯和甲苯 | 加入酸性高锰酸钾溶液 | 苯不能使高锰酸钾溶液褪色,甲苯能使高锰酸钾溶液褪色 |
 原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:
原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题: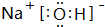 ,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;
,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;