题目内容
17.下列关于物质性质变化的比较,正确的是( )| A. | Na、Mg、Al还原性依次增强 | B. | HClO4、HIO4、HBrO4酸性依次减弱 | ||
| C. | KOH、NaOH、LiOH碱性依次减弱 | D. | S、Na、O原子半径依次减小 |
分析 A.同周期元素从左到右元素的金属性逐渐减弱,单质的还原性逐渐减弱;
B.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.电子层数越多半径越大,电子层数相同时核电荷数越多半径越小.
解答 解:A.同周期元素从左到右元素的金属性逐渐减弱,元素的非金属性越弱,则对应的单质的还原性越弱,故A错误;
B.元素的非金属性强弱的顺序为:Cl>Br>I,所以对应的最高价氧化物的水化物的酸性强弱为:HClO4>HBrO4>HIO4,故B错误;
C.金属性Li<Na<K,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,所以KOH、NaOH、LiOH碱性依次减弱,故C正确;
D.S、Na三个电子层数而硫的核电荷数多,氧两个电子层数,所Na、S、O原子半径依次减小,故D错误;
故选C.
点评 本题考查元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律以及对应单质、化合物的性质的比较角度和方法,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.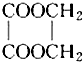 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
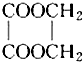 以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料用下列6种类型的反应来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )①氧化反应 ②消去反应 ③加成反应 ④酯化反应 ⑤水解反应 ⑥加聚反应.
| A. | ②③①⑤④ | B. | ②③⑤④① | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
8.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
| A. | 2H++2e-═H2↑ | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe-3e-═Fe3+ |
5.下列递变情况中,正确的是( )
| A. | Na、Mg、Al原子的最外层电子数依次减少 | |
| B. | N、O、F元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Li、Na、K的金属性依次减弱 |
12.在下列物质中,既含离子键又含共价键的是( )
| A. | MgCl2 | B. | NaOH | C. | H2O | D. | Cl2 |
2.某烃的结构简式为: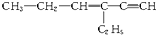 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
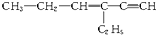 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )| A. | 4,3,5 | B. | 4,3,6 | C. | 2,5,4 | D. | 4,6,4 |
6.下列说法正确的是( )
| A. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| B. | 石油裂解和油脂皂化都是高分子生成小分子的过程 | |
| C. | 分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸 | |
| D. | 乙醇、乙酸和乙醛能用新制Cu(OH)2悬浊液鉴别 |
11.下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是( )
| A. | 碘和氯化钾 | B. | 金刚石和冰晶石 | C. | 二氧化硅和干冰 | D. | 冰和冰醋酸 |
 原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:
原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题: ,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;
,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;