题目内容
7. 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.(1)某同学为研究该实验,查阅有关资料得到如下数据:
①该同学推测,铝热反应所得到的熔融物是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?合理(填“合理”或“不合理”)
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用的试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
③实验室溶解该熔融物,下列试剂中最好的是B(填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
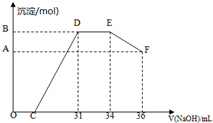
(2)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价就越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如图所示.
回答下列问题:
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O,上述现象说明溶液中H+、Fe3+、Al3+结合OH-的能力比NH4+强(填离子符号).
③B点与A点的差值为0.008摩尔.
分析 (1)①铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金;
②根据铝与NaOH溶液反应的性质设计实验方案;
③A.浓硫酸易使铁、铝钝化,不能使合金溶解;
B.活泼金属与稀硫酸反应;
C.稀硝酸与金属反应生成污染性气体;
D.铁不与NaOH溶液反应.
(2)①O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,以此书写离子方程式;
②D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,以此书写离子方程式;根据反应顺序确定结合OH-的能力;
③B与A的差值为氢氧化铝的物质的量,由EF段消耗的氢氧化钠,根据Al(OH)3+OH-=AlO2-+2H2O,得出Al(OH)3的物质的量.
解答 解:(1)①铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,所以铝热反应所得到的熔融物应是铁铝合金,
故答案为:合理;
②铝与NaOH溶液反应生成气体,反应的化学方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属铝,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
③A.浓硫酸易使铁、铝钝化,不能使合金溶解,故A错误;
B.活泼金属与稀硫酸反应,熔融物可溶解于稀硫酸中,故B正确;
C.稀硝酸与金属反应生成污染性气体,不是最佳选择,故C错误;
D.铁不与NaOH溶液反应,不能将熔融物全部溶解,故D错误;
故答案为:B;
(2)①O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
故答案为:H++OH-═H2O;
②D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为:NH4++OH-═NH3•H2O;
上述现象说明溶液中最先结合OH-是氢离子,最后结合OH-是NH4+离子,所以溶液中的H+、Fe3+、Al3+离子结合OH-的能力强于是NH4+,
故答案为:NH4++OH-═NH3•H2O; H+;Fe3+;Al3+;NH4+;
③由图可知,EF段消耗的氢氧化钠溶液为36mL-34m=2mL,故该计算参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3+OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol,
故答案为:0.008.
点评 本题考查铝热反应、金属与硝酸的反应、离子方程式的书写、氧化还原反应、化学计算等知识点,题目难度较大,明确图中各阶段反应实质为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 容器内的原子总数不变 | B. | 容器内的分子总数不变 | ||
| C. | 容器内的压强保持不变 | D. | 容器内物质总质量不变 |
| A. | NaHSO3溶液中水的电离程度小于Na2SO3 溶液,也小于Na2SO4 溶液 | |
| B. | [HSO3-]>[SO32-]>[H2SO3 ] | |
| C. | 该溶液中由水电离出的[H+]为1×10-4mol/L | |
| D. | 加入少量NaOH使溶液的pH升高会使水的电离受到抑制 |
| A. | 氟化氢的电子式: | B. | HClO的结构式:H-Cl-O | ||
| C. | 甲基的电子式 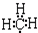 | D. | 基态氧原子L层电子排布图: |
| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
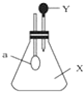 如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是CO2,Y是饱和NaHCO3浓溶液 | ||
| C. | X是SO2,Y是NaOH溶液 | D. | X是HCl,Y是NaNO3稀溶液 |
 某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.
某校化学课外活动小组设计如下图实验装置,完成探究某些物质的性质和比较性质强弱的实验.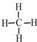 .乙烯的电子式是
.乙烯的电子式是 .将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5
.将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了1.4g,原混合气体中乙烯和甲烷的物质的量之比是1:5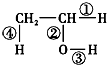 在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.
在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键.