题目内容
19.已知1g氢气完全燃烧生成水蒸气时放出的热量为121kJ,且氧气中1molO=O键完全断裂时吸收热量为496kJ,水蒸气中1molH-O键形成放出热量为463KJ,则氢气中2molH-H键断裂时吸收热量为( )| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
分析 化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量.
解答 解:氢气燃烧是放热反应,反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,1g氢气完全燃烧生成水蒸气时放出的热量为121kJ,则4g氢气完全燃烧生成水蒸气时放出的热量为484kJ,设氢气中1molH-H键断裂时吸收热量为x,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,则484=463kJ×4-(2x+496kJ),解得x=436KJ,则氢气中2molH-H键断裂时吸收热量为872kJ.
故选C;
点评 本题考查学生化学反应中的能量变化,掌握反应中能量的计算是解题的关键,难度不大.

练习册系列答案
相关题目
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 14g 乙烯和丁烯的混合物中含有3NA对共用电子对 | |
| B. | 1mol苯中含有3NA个碳碳双键 | |
| C. | 乙烷与Cl2在光照下反应,每有NA个氢原子被氯替代,需消耗标准状况下Cl2 11.2L | |
| D. | 标准状况下,22.4L己烷中的碳原子数为6NA |
10.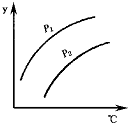 如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )
如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )
 如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )
如图表示不同温度和压强下,对可逆反应2L(气)?2M(气)+N(气)△H>0平衡状态的影响(p1<p2),图中y轴表示的意义是( )| A. | 一定条件下L的转化率 | B. | 气体混合物的平均摩尔质量 | ||
| C. | 气体混合物中L的体积分数 | D. | 气体L的物质的量 |
14.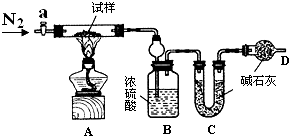 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
实验过程:
Ⅰ、按图组装仪器,检查装置的气密性;
Ⅱ、将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
Ⅲ、关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ、称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置C的作用为吸收反应生成的水蒸气.装置D的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的是使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是bce(填选项字母).
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:$\frac{42({m}_{5}-{m}_{3})}{11m{\;}_{1}}$×100%.
 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.实验过程:
Ⅰ、按图组装仪器,检查装置的气密性;
Ⅱ、将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
Ⅲ、关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
Ⅳ、称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O、Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置C的作用为吸收反应生成的水蒸气.装置D的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的是使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是bce(填选项字母).
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m2、m5 |
 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
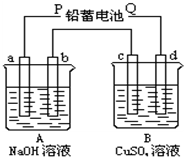 用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发). ;
;