题目内容
5.把盛有甲烷和氯气混合物的密闭容器放在光亮的地方,二者反应,下列叙述不正确的是( )| A. | 容器内的原子总数不变 | B. | 容器内的分子总数不变 | ||
| C. | 容器内的压强保持不变 | D. | 容器内物质总质量不变 |
分析 A.化学变化前后原子的种类不变即元素种类不变,原子个数也没有增减;
B.根据化学方程式可知,容器内分子总数不变;
C.甲烷与氯气反应是气体的物质的量减小的反应;
D.反应前后原子个数不变,根据质量守恒来分析.
解答 解:A.原子是化学变化中的最小微粒,即化学变化前后原子的种类不变、原子的数目没有增减,故A正确;
B.CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,根据化学方程式可知,容器内分子总数不变,故B正确;
C.由于生成的二氯甲烷、三氯甲烷和四氯化碳均为油状液体,故甲烷与氯气反应是气体的物质的量减小的反应,反应后压强减小,故C错误;
D.反应前后原子个数和种类不变,根据质量守恒可知,容器内的物质的总质量不变,故D正确.
故选C.
点评 本题考查质量守恒定律、化学反应中压强的变化,来进行溶液内原子个数.物质的质量的变化的判断等,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15. 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| B. | HB的电离方程式为HB=H++B- | |
| C. | NaA的水溶液中,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
16.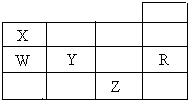 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | X、Y、Z的阴离子电子层结构均与R原子的相同 | |
| B. | 常压下,Y单质的沸点比Z单质的沸点高 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性强 | |
| D. | 最高价氧化物的水化物酸性W比Y强 |
20.下列实验现象描述错误的是( )
| A. | 硫在空气中燃烧,产生蓝紫色火焰 | |
| B. | 将二氧化碳通入水中,无明显现象 | |
| C. | 红亮的铜丝在酒精灯火焰上灼烧,铜丝表面变黑 | |
| D. | 一氧化碳通过灼热的氧化铁,红色固体变黑 |
10.下列有关实验数据处理,正确的是( )
| A. | 用pH试纸测得新制氯水的pH为2 | |
| B. | 中和滴定实验中,滴定管内液面对应的刻度由0 mL变为10 mL | |
| C. | 某同学在托盘天平左盘放置5g砝码,游码位于0.5g处,则所得药品质量为5.5g | |
| D. | 质量分数为20%的NaCl溶液与水等质量混合,稀释后溶液的质量分数必为10% |
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 14g 乙烯和丁烯的混合物中含有3NA对共用电子对 | |
| B. | 1mol苯中含有3NA个碳碳双键 | |
| C. | 乙烷与Cl2在光照下反应,每有NA个氢原子被氯替代,需消耗标准状况下Cl2 11.2L | |
| D. | 标准状况下,22.4L己烷中的碳原子数为6NA |
 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.