题目内容
3.DME(二甲醚、CH3OCH3)是一种重要的清洁能源,可作为柴油的理想替代燃料和民用燃料,被誉为“二十一世纪的新能源”.另外,二甲醚还被广泛用作致冷剂、气雾剂以及有机化工中间体.(1)工业上一步法制二甲醚的生产流程如下:
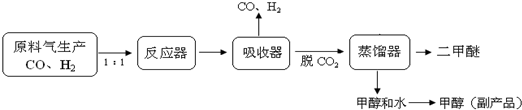
在一定的温度(230-280℃)、压强(2-10MPa)和催化剂作用下,反应器中进行下列一些反应:
CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
①反应器中总反应式可表示为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),则该反应的△H=:-246.1kJ/mol.
②在生产过程中反应器必须要进行换热,以保证反应器的温度控制在230-2800C,其原因是因为这些反应均为放热反应,随着反应的进行,反应器内温度必升高.而温度升高,化学平衡向左移动,同时,温度不断升高,催化剂的活性将降低,均不利于二甲醚的合成.
(2)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变 B.容器内压强保持不变
C.v(CO2):v(H2)=1:3 D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(3)如图为二甲醚燃料电池的工作原理示意图.请回答下列问题:
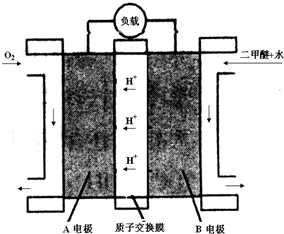
①A电极是正极.
②B电极上发生的电极反应式是CH3OCH3+3H2O-12e-═2CO2+12H+.
③若燃料电池中通入二甲醚(沸点为-24.9℃)的速率为1.12L/min(标准状况),以该燃料电池作为电源电解2mol•L-1CuSO4溶液500mL,则通电30秒钟后理论上在阴极可析出金属铜7.2g(假设整个过程中,能量利用率为75%).
分析 (1)①由反应①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1,②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1,将①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,根据盖斯定律可计算反应的△H;
②反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产;
(2)化学平衡状态的标志是正逆反应速率相同,各组分浓度保持不变,分析选项判断;
(3)依据图示分析通入氧气的一端为正极,通入二甲醚的一端为负极,电解质溶液为酸性环境,二甲醚失电子生成二氧化碳,根据电子守恒写出电极反应;依据二甲醚通入的量计算物质的量,结合电子守恒计算析出铜的质量
解答 解:(1)①已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol,②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol,由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
故答案为:-246.1kJ/mol;
②因为这些反应均为放热反应,随着反应的进行,反应器内温度必升高.而温度升高,化学平衡向左移动,同时,温度不断升高,催化剂的活性将降低,均不利于二甲醚的合成,所以反应器的温度控制在230-2800C,
故答案为:因为这些反应均为放热反应,随着反应的进行,反应器内温度必升高.而温度升高,化学平衡向左移动,同时,温度不断升高,催化剂的活性将降低,均不利于二甲醚的合成;
(2)根据:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0可知,该反应为气体体积减小的吸热反应,所以在一定温度下,体积恒定的密闭容器中,
A.反应前后气体质量守恒,体积固定,所以过程中密度不变,容器的密度不变不能证明反应达到平衡,故A错误;
B.反应前后气体体积变化,容器内压强保持不变说明反应达平衡状态,故B正确;
C.v(CO2):v(H2)=1:3无法判断正逆反应速率是否相等,故C错误;
D.单位时间内消耗2mol CO2,同时消耗1mol二甲醚证明反应的正逆反应速率相同,能说明反应达到平衡,故D正确;
故答案为:BD;
(3)①反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极发生还原反应,氧气在正极放电,故A为正极,
故答案为:正极;
②由①分析可知,B极为负极,A为正极,二甲醚放电生成二氧化碳与氢离子,B电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+,
故答案为:CH3OCH3+3H2O-12e-═2CO2+12H+;
③若以1.12L•min-1(标准状况)的速率向该电池中通入二甲醚,用该电池电解500mL 2mol•L-1 CuS04溶液,通电0.50min后,通入二甲醚物质的量=$\frac{1.12L/min×0.50min}{22.4L/mol}$=0.025mol;
依据电极反应电子守恒,CH3OCH3--12e---6Cu2+,整个过程中,能量利用率为75%,
n(Cu2+)=0.025mol×75%×6=0.1125mol
m(Cu)=0.1125mol×64g/mol=7.2g,所以理论上可析出金属铜的质量7.2g,
故答案为:7.2.
点评 本题综合性较大,涉及反应热、化学平衡、原电池、实验基本操作等,难度中等,(3)中电极反应式书写是易错点,可以先写出正极电极反应式,利用总反应式减正极反应式即为负极反应式,注意电子守恒的计算应用.

 同步奥数系列答案
同步奥数系列答案| A. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 对于反应①C+CO2?2CO(△H>0)和反应②N2+3H2?2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢 | |
| D. | NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ |
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:3:4 | |
| D. | 单位时间消耗0.1 molX同时生成0.4molZ |
| A. | Na2S04溶液加人BaCl2固体 | B. | Ba(0H)2溶液中加人CuS04(少量)固体 | ||
| C. | Na0H溶液通人HCl | D. | H2O中加人NaCl固体 |
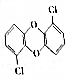 焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )
焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )| A. | 二噁英的摩尔质量是253 | |
| B. | 1 mol二噁英含有2mol氧原子 | |
| C. | 二噁英属于高分子化合物 | |
| D. | 1 mol二噁英在标准状况下的体积约为22.4L |
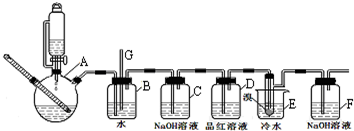
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体[ | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)实验开始之前必要的操作是检查装置的气密性.
(2)A中反应的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出(答出其中两条即可).
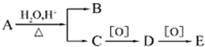 有机物A的分子式为C10H20O2,可发生如图的转化,其中B与E互为同分异构体且为同类物质,则A可能的结构有( )
有机物A的分子式为C10H20O2,可发生如图的转化,其中B与E互为同分异构体且为同类物质,则A可能的结构有( )| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |