题目内容
8.1,2-二溴乙烷可作汽油抗爆剂的添加剂,下图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).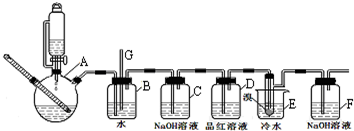
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体[ | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)实验开始之前必要的操作是检查装置的气密性.
(2)A中反应的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出(答出其中两条即可).
分析 实验室制备1,2-二溴乙烷流程:装置A中:乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,安全瓶B可以防止倒吸;当堵塞时,气体不畅通,则在B中气体产生的压强将水压入直玻璃管G中,甚至溢出玻璃管,装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化硫发生反应,除去乙烯中带出的酸性气体,装置D中品红溶液验证二氧化硫是否被除尽,液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,E装置中:乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用F吸收,
(1)因反应过程中有气体参与,所以实验开始之前必要的操作是检查装置的气密性;
(2)装置A中的反应为乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯;
(3)如果B中压强增大,玻璃管中液面会上升,应停止加热,向烧杯E中加适量温水
(4)二氧化硫能使品红褪色;
(5)液溴易挥发,冷水冷却,能减少液溴挥发;由表中数据可知温度太低,1,2-二溴乙烷会凝结为固体;
(6)液溴为红棕色,产物1,2-二溴乙烷为无色,根据颜色变化判断反应是否结束;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;
解答 解:(1)因反应过程中有气体参与,所以实验开始之前必要的操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)装置A中的反应为乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)如果B中压强增大,玻璃管G中液面会上升,可能产生乙烯的速率过快,导致E装置内乙烯和溴单质来不及完全反应逸出,导致压强增大,所以实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是:停止加热减慢乙烯产生速率,向烧杯E中加适量温水提高E中反应速率,
故答案为:停止加热,向烧杯E中加适量温水;
(4)无水乙醇和浓硫酸混合液制备乙烯时,会有副产物二氧化硫生成,而二氧化硫能使品红褪色,所以用品红溶液检验二氧化硫是否被氢氧化钠吸收完全,
故答案为:验证二氧化硫是否被除尽;
(5)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,
故答案为:减少液溴挥发;
(6)液溴为红棕色,产物1,2-二溴乙烷为无色,当反应结束时液溴全部转化为1,2-二溴乙烷,E中液体由红棕色变为无色;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发,会导致无水乙醇消耗量大大超过理论值,
故答案为:装置E中小试管内的液体由红棕色变为无色;有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出.
点评 本题考查有机物1,2-二溴乙烷的制取实验设计,解答本题的关键是把握制备实验的原理,牢固把握实验基本操作以及除杂问题是解答该类题目的保证,题目难度中等.

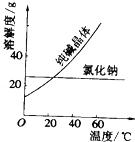 阅读、分析下列两个材料:
阅读、分析下列两个材料:材料一(如图):
材料二:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
①将乙二醇和丙三醇相互分离的最佳方法是D.
②提取碘水中的碘,可综合选用上述三种方法依次是F、A、D.
③将含有氯化钠杂质的纯碱提纯出来,最好应用B.
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 64g SO2含有NA个SO2分子 | |
| C. | 16g CH4所含的电子数为NA | |
| D. | 标况下,4.48L的水中含有H2O分子的数目为0.2NA |
| A. | 用试管取出试剂瓶中的K2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Cu(NO3)2溶于水,可将含有Cu(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
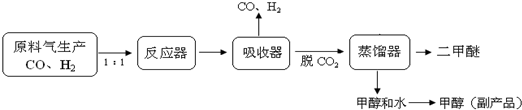
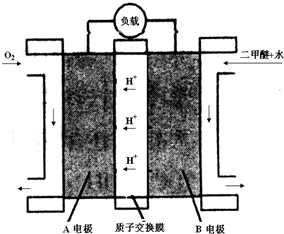
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
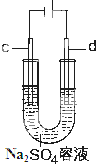 在25℃时,将一根石墨棒和一根铁棒做两电极分别插入一定量的硫酸钠饱和溶液中进行电解(见图),
在25℃时,将一根石墨棒和一根铁棒做两电极分别插入一定量的硫酸钠饱和溶液中进行电解(见图),