题目内容
8.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p5;②1s22s22p63s23p3;③1s22s22p33s23p4;④1s22s22p5.则下列有关比较中正确的是( )| A. | 第一电离能:④>①>②>③ | B. | 原子半径:①>③>②>④ | ||
| C. | 电负性:④>③>②>① | D. | 最高正化合价:④=①>③>② |
分析 由四种元素基态原子电子排布式可知,①1s22s22p63s23p5是Cl元素、②1s22s22p63s23p3是P元素、③1s22s22p33s23p4是S元素、④1s22s22p5是F元素,
A、同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能降低,注意全满、半满稳定状态;
B、根据同周期自左而右原子半径减小、电子层越多原子半径越大分析判断;
C、同周期自左而右电负性增大,非金属性越强电负性越大;
D、最高正化合价等于最外层电子数,但F元素没有正化合价.
解答 解:由四种元素基态原子电子排布式可知,①1s22s22p63s23p5是Cl元素、②1s22s22p63s23p3是P元素、③1s22s22p33s23p4是S元素、④1s22s22p5是F元素.
A、同周期自左而右第一电离能呈增大趋势,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能S<P<Cl,同主族自上而下第一电离能降低,所以第一电离能F>Cl,所以第一电离能S<P<Cl<F,即:④>①>②>③,故A正确;
B、同周期自左而右原子半径减小,所以原子半径P>S>Cl,电子层越多原子半径越大,所以原子半径Cl>F,故原子半径P>S>Cl>F,即②>③>①>④,故B错误;
C、同周期自左而右电负性增大,所以电负性P<S<Cl,同主族从上到下电负性减弱,所以电负性F>Cl,故电负性P<S<Cl<F,即②<③<①<④,故C错误;
D、最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>③>②,故D错误.
故选:A.
点评 本题考查结构与物质关系、核外电子排布规律、元素周期律等,难度中等,根据原子结构推断元素是关键,注意基础知识的掌握.

| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
| A. | 碘化钾--食盐中的加碘物质 | B. | 二氧化硅--太阳能电池 | ||
| C. | 福尔马林--食品保鲜剂 | D. | 水玻璃--耐火材料 |
| A. | R的氧化物都能溶于水 | |
| B. | R的最高价氧化物对应的水化物都是H2RO3 | |
| C. | R是非金属元素 | |
| D. | R的氧化物都能与NaOH溶液反应 |
| A. | K+、NH4+、NO3-、Cl- | B. | Na+、K+、NH4+、Cl- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Cu2+、Br-、Cl- |
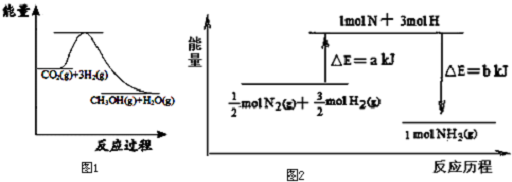
 .
.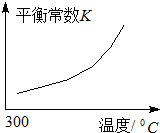 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.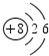 .
.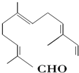 现有试剂:
现有试剂: