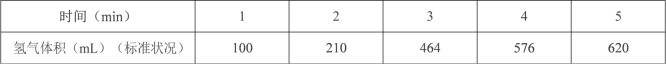题目内容
【题目】许多过渡金属离子对多种配体有很强结合力,能形成种类繁多的配合物。下列说法错误的是( )
A.CuCl2溶液呈黄绿色,是由于存在配离子[CuCl4]2-
B.配合物[PtCl2(NH3)2]为平面结构,存在顺反异构体
C.配合物[Ti(OH)4(H2O)2]2+中Ti4+的配位数是4
D.向配合物[TiCl(H2O)5]Cl2·H2O溶液中加入足量AgNO3溶液,只有![]() 的Cl被沉淀
的Cl被沉淀
【答案】C
【解析】
A. 在CuCl2的水溶液中存在如下平衡[Cu(H2O)4]2++4Cl-![]() [CuCl4]2-+4H2O,故A正确;
[CuCl4]2-+4H2O,故A正确;
B. 配合物[PtCl2(NH3)2]为平面结构,有 、
、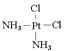 两种结构,所以存在顺反异构体,故B正确;
两种结构,所以存在顺反异构体,故B正确;
C. 配合物[Ti(OH)4(H2O)2]2+中Ti4+的配体是OH-、H2O,配位数是6,故C错误;
D. 内界的氯不能电离,外界的氯能电离,向配合物[TiCl(H2O)5]Cl2·H2O的溶液中加入足量AgNO3溶液,只有![]() 的Cl生成氯化银沉淀,故D正确;
的Cl生成氯化银沉淀,故D正确;
选C。

【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
0~10min内,平均反应速率υ(O2)__ mol·L-1·min-1;当升高温度,该反应的平衡常数K_____(填“增大”“减小”或“不变”)。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
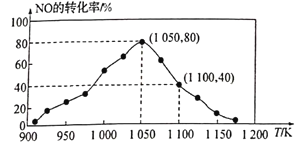
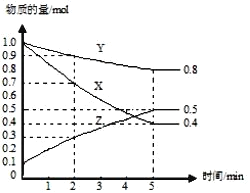
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__________;在1100K时,CO2的体积分数为_____。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___ [已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____。
=_____。
【题目】硫酸参与热化学循环可通过二步循环或三步循环制取氢气,其中三步循环(碘硫热化学循环)原理如下图所示:

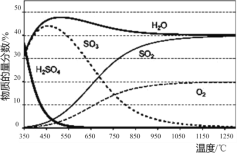
(1)“步骤Ⅰ.硫酸热分解”在恒容密闭容器中进行,测得各物质的物质的量分数与温度的关系如下图所示。其在650~1200℃间发生的主要反应的方程式为____。
(2)“步骤Ⅱ.硫酸再生”的离子方程式为____(HI是强酸)。
(3)步骤Ⅲ的反应为2HI(g) ![]() H2(g) + I2(g) 。
H2(g) + I2(g) 。
①若在恒温恒容密闭容器中进行该反应,能说明已达到平衡状态的是___(填序号)。
a.容器内气体的总压强不再随时间而变化
b.n(HI)∶n(H2)∶n(I2)=2∶1∶1
c.反应速率:v(H2)正=v(H2)逆
d.I2(g)浓度不再随时间的变化而变化
②已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能。相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的![]() H为____kJ·mol-1。
H为____kJ·mol-1。
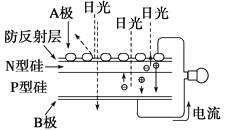
(4)将“三步循环”中步骤Ⅱ、Ⅲ用下图装置代替即为“二步循环”。
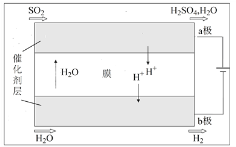
下列有关该装置的相关说法正确的是____(填序号)。
a.化学能转变为电能
b.催化剂可加快电极上电子的转移
c.反应的总方程式为SO2+2H2O ![]() H2+H2SO4
H2+H2SO4
d.每生成1molH2,电路中流过的电子数约为6.02×1023