题目内容
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
0~10min内,平均反应速率υ(O2)__ mol·L-1·min-1;当升高温度,该反应的平衡常数K_____(填“增大”“减小”或“不变”)。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
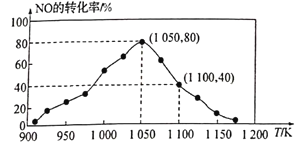
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__________;在1100K时,CO2的体积分数为_____。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___ [已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____。
=_____。
【答案】0.021 减小 1050K前反应末达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 20% 4 < ![]() 或0.25
或0.25
【解析】
(1)先算Δc(O2),再算速率,再根据温度变化影响平衡移动得出。
(2)在1050K前反应未达到平衡状态,随着温度升高,反应速率加快;根据题意假设加入1 mol NO,再根据转化率进行计算,得出体积分数。
(3)先假设加入1mol NO,根据平衡时转化率得到n(NO)、n(N2)、n(CO2),再算出各物质的平衡分压,再根据压强平衡常数计算。
(4)①正反应为放热反应,升高温度平衡向左移动,则正反应速率增大的倍数小于逆反应速率增大的倍数。
②当反应达到平衡时,υ正=υ逆,先计算平衡时c(CO)、c(NO)、c(N2)、c(CO2),再计算比值。
(1)在0![]() 10min内,Δc(O2)=1.0mol/L-0.79mol/L=0.21mol/L,故
10min内,Δc(O2)=1.0mol/L-0.79mol/L=0.21mol/L,故![]() ;正反应为放热反应,升高温度,平衡向左移动,故化学平衡常数K减小,故答案为:0.021;减小。
;正反应为放热反应,升高温度,平衡向左移动,故化学平衡常数K减小,故答案为:0.021;减小。
(2)在1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;达到平衡后,升高温度,平衡向左移动,NO转化率降低。根据反应C(s)+2NO(g) ![]() N2(g)+CO2(g),假设加入1 mol NO,在1100 K时,α(NO)= 40%,则Δn(NO)=0.4 mol,故n(CO2)=0.2 mol,由于反应前后气体的总物质的量不变,故混合气体中CO2的体积分数为
N2(g)+CO2(g),假设加入1 mol NO,在1100 K时,α(NO)= 40%,则Δn(NO)=0.4 mol,故n(CO2)=0.2 mol,由于反应前后气体的总物质的量不变,故混合气体中CO2的体积分数为![]() ,故答案为:1050K前反应末达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;20%。
,故答案为:1050K前反应末达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;20%。
(3)根据反应C(s)+2NO(g) ![]() N2(g)+CO2(g),假设加入1mol NO,在1050K时,α(NO)=80%,平衡时,n(NO)=0.2mol,n(N2)=0.4mol,n(CO2)=0.4mol,各物质的平衡分压为
N2(g)+CO2(g),假设加入1mol NO,在1050K时,α(NO)=80%,平衡时,n(NO)=0.2mol,n(N2)=0.4mol,n(CO2)=0.4mol,各物质的平衡分压为![]() ,
,![]() ,
,![]() ,故反应的化学平衡常数
,故反应的化学平衡常数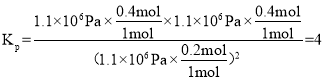 ,故答案为:4。
,故答案为:4。
(4)①正反应为放热反应,升高温度平衡向左移动,则正反应速率增大的倍数小于逆反应速率增大的倍数,浓度不变,故k正增大的倍数小于k逆增大的倍数;
②当反应达到平衡时,υ正=υ逆,故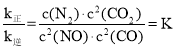 ,根据热化学方程式可知,平衡时c(CO)=c(NO)=0.6mol/L,c(N2)=0.2mol/L,c(CO2)=0.4mol/L,故
,根据热化学方程式可知,平衡时c(CO)=c(NO)=0.6mol/L,c(N2)=0.2mol/L,c(CO2)=0.4mol/L,故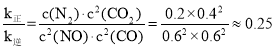 ,故答案为:0.25。
,故答案为:0.25。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有机物A仅含有C、H、O三种元素,常温下为无色粘稠液体,易溶于水。为研究A 的组成与结构,化学研究性学习小组进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A 4.5g,加热使其汽化,测其密度是相同条件下H2的45倍。 | (1)A的相对分子质量为__ |
(2)将此4.5gA在足量O2中充分燃烧,并使其产物依次缓缓通过盛有足量浓硫酸、氢氧化钠溶液的洗气瓶,发现两者分别增重2.7g和6.6g。 | (2)A的分子式为__ |
(3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2,若与足量金属钠反应则生成1.12LH2(气体体积均在标准状况下测定)。 | (3)用结构简式表示A中含有的官能团: ___ |
(4)A的1H核磁共振氢谱如下图:
| (4)A的结构简式为______ |
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
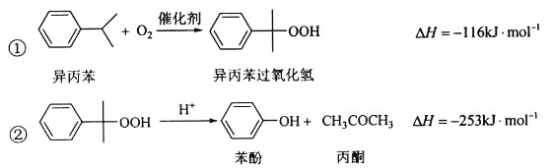
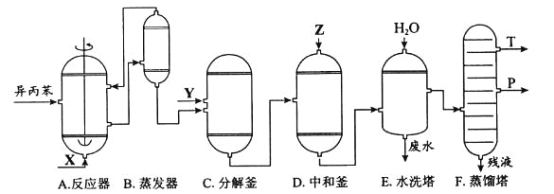
相关化合物的物理常数:
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是_______。
(2)反应①和②分别在装置_______和________中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是_____,优点是用量少,缺点是__________。
(4)反应②为_____(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是_____。
(5)中和釜D中加入的Z最适宜的是__________(填编号)
a.NaOH b.CaCO3c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为_______和________,判断的依据是______。
(7)用该方法合成苯酚和丙酮的优点是____________。
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
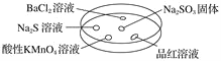
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00