��Ŀ����
����Ŀ����������Ȼ�ѧѭ����ͨ������ѭ��������ѭ����ȡ��������������ѭ���������Ȼ�ѧѭ����ԭ������ͼ��ʾ��

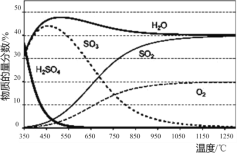
��1���������.�����ȷֽ⡱�ں����ܱ������н��У���ø����ʵ����ʵ����������¶ȵĹ�ϵ����ͼ��ʾ������650��1200��䷢������Ҫ��Ӧ�ķ���ʽΪ____��
��2���������.���������������ӷ���ʽΪ____��HI��ǿ�ᣩ��
��3�������ķ�ӦΪ2HI(g) ![]() H2(g) + I2(g) ��
H2(g) + I2(g) ��
�����ں��º����ܱ������н��и÷�Ӧ����˵���Ѵﵽƽ��״̬����___������ţ���
a���������������ѹǿ������ʱ����仯
b��n(HI)��n(H2)��n(I2)=2��1��1
c����Ӧ���ʣ�v(H2)��=v(H2)��
d��I2(g)Ũ�Ȳ�����ʱ��ı仯���仯
����֪���ѣ������ɣ�1mol��ѧ�����գ���ų�����������Ϊ���ܡ���ؼ����������£�
��ѧ�� | H��I | H��H | I��I |
����/kJ��mol��1 | 298.7 | 436.0 | 152.7 |
��÷�Ӧ��![]() HΪ____kJ��mol��1��
HΪ____kJ��mol��1��
��4����������ѭ�����в��������ͼװ�ô��漴Ϊ������ѭ������
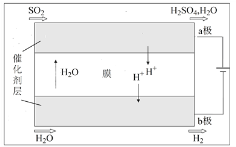
�����йظ�װ�õ����˵����ȷ����____������ţ���
a����ѧ��ת��Ϊ����
b�������ɼӿ�缫�ϵ��ӵ�ת��
c����Ӧ���ܷ���ʽΪSO2+2H2O ![]() H2+H2SO4
H2+H2SO4
d��ÿ����1molH2����·�������ĵ�����ԼΪ6.02��1023
���𰸡� 2SO3![]() 2SO2+O2 SO2 + I2 +2H2O
2SO2+O2 SO2 + I2 +2H2O ![]() 4H++2I��+SO42���� cd 8.7 bc
4H++2I��+SO42���� cd 8.7 bc
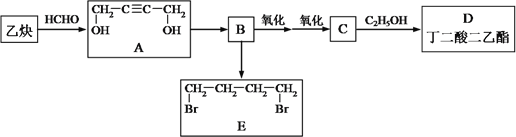
����������1������ͼ����Ϣ��֪�����ʵ������ٵ�Ϊ��Ӧ����ʵ������ӵ�Ϊ�������SO3Ϊ��Ӧ�SO2��O2Ϊ���������650��1200��䷢������Ҫ��Ӧ�ķ���ʽΪ2SO3![]() 2SO2+O2����2���������.�����������Ƕ������ⵥ�ʺ�ˮ���뷴Ӧ�������������ᣬ��Ӧ�����ӷ���ʽΪSO2 + I2 +2H2O
2SO2+O2����2���������.�����������Ƕ������ⵥ�ʺ�ˮ���뷴Ӧ�������������ᣬ��Ӧ�����ӷ���ʽΪSO2 + I2 +2H2O ![]() 4H++2I��+SO42������3����a����Ӧ2HI(g)
4H++2I��+SO42������3����a����Ӧ2HI(g) ![]() H2(g) + I2(g) Ϊ�����������ķ�Ӧ����Ӧ�����������ѹǿʼ�ղ��䣬�������������ѹǿ������ʱ����仯������Ϊƽ��״̬�ı�־���ʴ���b��n(HI)��n(H2)��n(I2)=2��1��1������������뷴Ӧ��һ����ƽ��״̬���ʴ���c����Ӧ���ʣ�v(H2)��=v(H2)����˵�����淴Ӧ������ͬ����Ӧ��ƽ��״̬������ȷ��d��I2(g)Ũ�Ȳ�����ʱ��ı仯���仯��˵����Ӧ�Ѵ�ƽ��״̬������ȷ����ѡcd���ڸ��ݷ�Ӧ�Ⱥͼ��ܵĹ�ϵ�ɵã�
H2(g) + I2(g) Ϊ�����������ķ�Ӧ����Ӧ�����������ѹǿʼ�ղ��䣬�������������ѹǿ������ʱ����仯������Ϊƽ��״̬�ı�־���ʴ���b��n(HI)��n(H2)��n(I2)=2��1��1������������뷴Ӧ��һ����ƽ��״̬���ʴ���c����Ӧ���ʣ�v(H2)��=v(H2)����˵�����淴Ӧ������ͬ����Ӧ��ƽ��״̬������ȷ��d��I2(g)Ũ�Ȳ�����ʱ��ı仯���仯��˵����Ӧ�Ѵ�ƽ��״̬������ȷ����ѡcd���ڸ��ݷ�Ӧ�Ⱥͼ��ܵĹ�ϵ�ɵã�![]() H=��+298.7��2-436.0-152.7��kJ��mol��1= +8.7kJ��mol��1����4��a����װ��Ϊ���أ��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ʴ���b�������ܸı仯ѧ��Ӧ���ʣ��ʴ����ɼӿ�缫�ϵ��ӵ�ת�ƣ�����ȷ��c����ӦΪ������������ˮת��Ϊ��������������ܷ���ʽΪSO2+2H2O
H=��+298.7��2-436.0-152.7��kJ��mol��1= +8.7kJ��mol��1����4��a����װ��Ϊ���أ��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ʴ���b�������ܸı仯ѧ��Ӧ���ʣ��ʴ����ɼӿ�缫�ϵ��ӵ�ת�ƣ�����ȷ��c����ӦΪ������������ˮת��Ϊ��������������ܷ���ʽΪSO2+2H2O ![]() H2+H2SO4������ȷ��d�����ݷ�ӦSO2+2H2O
H2+H2SO4������ȷ��d�����ݷ�ӦSO2+2H2O ![]() H2+H2SO4��ÿ����1molH2����·�������ĵ�����ԼΪ2��6.02��1023���ʴ���ѡbc��
H2+H2SO4��ÿ����1molH2����·�������ĵ�����ԼΪ2��6.02��1023���ʴ���ѡbc��