题目内容
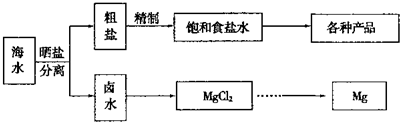
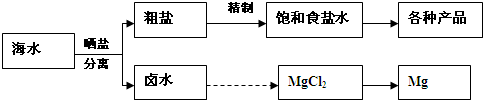
(12分)海水中蕴藏着丰富的资源,海水综合利用的流程图如下。
(1)用NaC1做原料可以得到多种产品。
①工业上由NaC1制备58.5kg金属钠时,可生成标准状况下的氯气 L。
②实验室用惰性电极电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式 。
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgC12粗产品。租产品的溶液中含有的Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)3呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。
若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为 ,最终控制溶液的pH值为 。MgC12粗产品在精制净化后,熔融、电解可得镁单质。环境专家认为可以用金属镁将水体中的NO3—还原为N2,从而消除污染。请补充完整以下离子方程式并配平:
NO3—+ Mg+ H2O= N2↑+ Mg(OH)2+
(3)碘在地壳中主要以NaIO3形式存在,在海水中主要以,I—的形式存在。几种粒子之间有如下转化关系:
①如以途径I制取I2,加的、C12要适量;如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3—。与C1—物质的量之比1:6,则氧化剂剂还原剂物质的量之比为 。
②如以途径Ⅱ在溶液中制I2,反应后溶液显酸性,则反应的离子方程式是 。

解析⑴①2Na ~ Cl2,V(Cl2)=58.5×103g/23g/mol×22.4L/mol×1/2=2.85×104L
②NaCl+H2O NaClO+H2↑
NaClO+H2↑
⑵NaClO;9.8,刚好使Mn2+ 沉淀完全;
2NO3—+5 Mg+6H2O=1 N2↑+5Mg(OH)2+2OH―
⑶①I―+3H2O+3Cl2=1IO3―+6Cl―+6H+氧化剂剂还原剂物质的量之比3:1
②2IO3―+5HSO3―=5SO42―+H2O+I2+3H+