题目内容
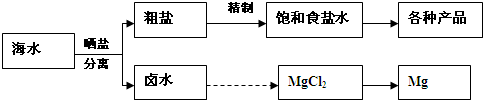
海水中蕴藏着丰富的资源.海水综合利用的流程图如图1.

(1)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,图2是该同学转移溶液的示意图,图中有两点错误请指出:
(2)用NaCl做原料可以得到多种产品.
实验室用惰性电极电解100mL 0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况,假设气体物质全部从溶液中逸出),则所得溶液的pH为
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图3所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①图中X、Y分别是
(4)图4欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).

(1)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,图2是该同学转移溶液的示意图,图中有两点错误请指出:
未用玻璃棒引流;未采用250mL容量瓶
未用玻璃棒引流;未采用250mL容量瓶
(2)用NaCl做原料可以得到多种产品.
实验室用惰性电极电解100mL 0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况,假设气体物质全部从溶液中逸出),则所得溶液的pH为
13
13
(忽略反应前后溶液的体积变化).(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图3所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①图中X、Y分别是
Cl2
Cl2
、H2
H2
(填化学式),②写出燃料电池B中正极发生的电极反应O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
;(4)图4欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).
分析:(1)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,配制多大体积的溶液要采用多大体积的容量瓶;
(2)根据反应物、产物写出相应的电解方程式,根据方程式进行计算;
(3)①根据离子放电原理判断产物; ②氢氧燃料电池正极上一定是氧气得电子的过程,在酸性环境下成为水分子,在碱性和中性环境下生成的是氢氧根离子;
(4)Cu和H2SO4之间的反应是非自发的,需要电解池实现,根据电解池的构成条件来回答.
(2)根据反应物、产物写出相应的电解方程式,根据方程式进行计算;
(3)①根据离子放电原理判断产物; ②氢氧燃料电池正极上一定是氧气得电子的过程,在酸性环境下成为水分子,在碱性和中性环境下生成的是氢氧根离子;
(4)Cu和H2SO4之间的反应是非自发的,需要电解池实现,根据电解池的构成条件来回答.
解答:解:(1)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,故答案为:未用玻璃棒引流;未采用250 mL容量瓶;
(2)因电解饱和食盐水的方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,当产生的H2的体积为112mL即0.005mol时,生成氢氧化钠的物质的量为0.01mol,所以溶液中NaOH的物质的量浓度=
═0.1mol/L,所以氢离子的浓度为
=1×10-13mol/L,PH=13,故答案为:13;
(3)①电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子得电子生成氢气的过程,故答案为:Cl2,H2;
②氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O,其正极反应表示为:O2+2H2O+4e-=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(4)Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即: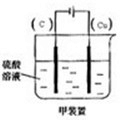 ,故答案为:
,故答案为: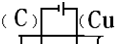 .
.
(2)因电解饱和食盐水的方程式:2NaCl+2H2O
| ||
| 0.01mol |
| 0.1L |
| 1×10 -14 |
| 0.1 |
(3)①电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子得电子生成氢气的过程,故答案为:Cl2,H2;
②氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O,其正极反应表示为:O2+2H2O+4e-=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(4)Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即:
 ,故答案为:
,故答案为: .
.点评:本题考查一定物质的量浓度的溶液的配制、原电池和电解池的工作原理,难度不大,注意电极反应式的书写及根据化学方程式进行计算.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目