题目内容
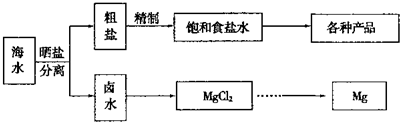
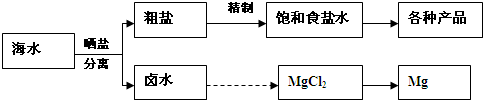
海水中蕴藏着丰富的资源.海水综合利用的示意图如下:
下列说法正确的是( )

下列说法正确的是( )
分析:A.氯碱工业主要产品是氢氧化钠和氯气,根据物质间的反应确定产品;
B.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子.盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
C.若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl;
D.活泼金属采用电解其熔融盐或氧化物的方法冶炼.
B.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子.盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
C.若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl;
D.活泼金属采用电解其熔融盐或氧化物的方法冶炼.
解答:解:A.氯碱工业主要产品是氢氧化钠和氯气,延伸产品可以有NaClO、盐酸、Na2CO3等,故A正确;
B.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸,故B正确;
C.若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2,故C错误;
D.镁是活泼金属,如果电解氯化镁溶液,阴极上氢离子放电而不是镁离子放电,所以得不到镁单质,工业上用电解熔融氯化镁的方法冶炼镁,故D错误;
故选AB.
B.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸,故B正确;
C.若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2,故C错误;
D.镁是活泼金属,如果电解氯化镁溶液,阴极上氢离子放电而不是镁离子放电,所以得不到镁单质,工业上用电解熔融氯化镁的方法冶炼镁,故D错误;
故选AB.
点评:本题考查了物质的分离和提纯、金属的冶炼等知识点,难度不大,注意由MgCl2?6H2O获得氯化镁的方法,为易错点.

练习册系列答案
相关题目