题目内容
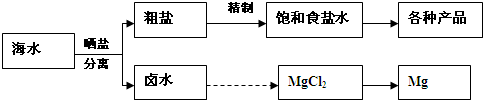
Ⅰ海水中蕴藏着丰富的资源.海水综合利用的流程图如下.
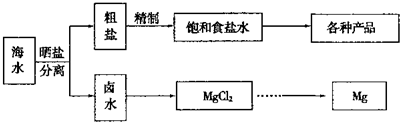
用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是
②实验室用惰性电极电解500mL0.1mol/LNaCl溶液,若阴阳两极共得到112mL气体(标准状况),则所得溶液的pH为
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的总化学方程式:
Ⅱ铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的Al2O3和SiO2,用如图所示的装置(甲、乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用稀硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:
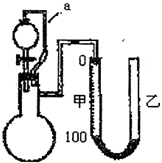
(1)装置中导管a所起的作用是
(2)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意
A.反应前后读取甲管液面数据时应使甲、乙中液面保持水平
B.反应后读取甲管液面数据时,甲、乙两管液面无须保持水平
C.反应后立即读取甲管液面数据,防止液面变动
D.反应后静置一会,需待反应器恢复原来温度
(3)若从稀硫酸和氢氧化钠溶液中挑选一种试剂,你选择的试剂是


用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是
2NaCl
2Na+Cl2↑
| ||
2NaCl
2Na+Cl2↑
.
| ||
②实验室用惰性电极电解500mL0.1mol/LNaCl溶液,若阴阳两极共得到112mL气体(标准状况),则所得溶液的pH为
12
12
(忽略反应前后溶液的体积变化)③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的总化学方程式:
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.
| ||
Ⅱ铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的Al2O3和SiO2,用如图所示的装置(甲、乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用稀硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:

(1)装置中导管a所起的作用是
平衡气压,使分液漏斗中的液体顺利滴下
平衡气压,使分液漏斗中的液体顺利滴下
.(2)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意
AD
AD
.A.反应前后读取甲管液面数据时应使甲、乙中液面保持水平
B.反应后读取甲管液面数据时,甲、乙两管液面无须保持水平
C.反应后立即读取甲管液面数据,防止液面变动
D.反应后静置一会,需待反应器恢复原来温度
(3)若从稀硫酸和氢氧化钠溶液中挑选一种试剂,你选择的试剂是
NaOH溶液
NaOH溶液
,不选择另一种试剂的理由是由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差
由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差
.分析:I.(1)①根据电解原理书写;
②根据电解方程式和pH的计算思考;
③根据电解饱和食盐水的方程式和氯气的性质思考;
II.(1)从烧瓶和分液漏斗的压强考虑;
(2)从测量体积的温度和压强思考;
(3)从能否使铝完全反应的角度分析.
②根据电解方程式和pH的计算思考;
③根据电解饱和食盐水的方程式和氯气的性质思考;
II.(1)从烧瓶和分液漏斗的压强考虑;
(2)从测量体积的温度和压强思考;
(3)从能否使铝完全反应的角度分析.
解答:解:I(1)①用氯化钠制取金属钠,采用电解熔融状态的氯化钠,生成钠和氯气,即为2NaCl
2Na+Cl2↑,故答案为:2NaCl
2Na+Cl2↑;
②用惰性电极电解食盐水,阴极生成氢气,阳极生成氯气,化学方程式为:2NaCl+2HO
2NaOH+H2↑+Cl2↑.生成的氯气和氢气共
=0.005mol,则根据化学方程式,生成0.5mol氢气和氯气则生成0.5mol氢氧化钠,即氢氧化钠的浓度为
=0.01mol/L,则氢离子浓度为
=其10-12,pH为12,故答案为:12;
③电解氯化钠制取“84消毒液”,是让生成的氯气与氢氧化钠继续发生反应,将两个化学方程式:2NaCl+2HO=2NaOH+H2↑+Cl2↑、Cl2+2NaOH=NaCl+NaClO+H2O左右加和得总反应式:
NaCl+H2O
NaClO+H2↑,故答案为:NaCl+H2O
NaClO+H2↑;
II.(1)导管a把烧瓶和分液漏斗连通,使其压强一致,始终使分液漏斗与烧瓶内的压强一致,维持一段液柱差,让液体能够顺利滴下,即平衡气压,使分液漏斗中的液体顺利滴下.
故答案为:平衡气压,使分液漏斗中的液体顺利滴下;
(2)在反应前后应注意使左右两管液面相平,即使烧瓶中的压强与外界大气压相等,使读取的气体体积为外界大气压下的体积,即A正确,B错误.
在反应结束后,应先冷却气体的温度至室温,这样读取的气体的体积才是常温下的气体体积,即C错误,D正确.
故答案为:AD;
(3)由于铝粉中含有少量的Al2O3和SiO2,选用氢氧化钠会与铝、Al2O3和SiO2发生反应,即能使铝完全反应,测定结果准确;若选用硫酸,由于硫酸不与SiO2发生反应,可能会使硫酸不能与SiO2包裹的铝反应,导致测定结果不准确.即答案为:NaOH溶液;由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差.选用硫酸,其理由因为:能与硫酸反应,产生氢气,可以给一半的分数.
故答案为:NaOH溶液;由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差.
| ||
| ||
②用惰性电极电解食盐水,阴极生成氢气,阳极生成氯气,化学方程式为:2NaCl+2HO
| ||
| 0.112L |
| 22.4L/mol |
| 0.005mol |
| 0.5L |
| 10-14 |
| 0.01 |
③电解氯化钠制取“84消毒液”,是让生成的氯气与氢氧化钠继续发生反应,将两个化学方程式:2NaCl+2HO=2NaOH+H2↑+Cl2↑、Cl2+2NaOH=NaCl+NaClO+H2O左右加和得总反应式:
NaCl+H2O
| ||
| ||
II.(1)导管a把烧瓶和分液漏斗连通,使其压强一致,始终使分液漏斗与烧瓶内的压强一致,维持一段液柱差,让液体能够顺利滴下,即平衡气压,使分液漏斗中的液体顺利滴下.
故答案为:平衡气压,使分液漏斗中的液体顺利滴下;
(2)在反应前后应注意使左右两管液面相平,即使烧瓶中的压强与外界大气压相等,使读取的气体体积为外界大气压下的体积,即A正确,B错误.
在反应结束后,应先冷却气体的温度至室温,这样读取的气体的体积才是常温下的气体体积,即C错误,D正确.
故答案为:AD;
(3)由于铝粉中含有少量的Al2O3和SiO2,选用氢氧化钠会与铝、Al2O3和SiO2发生反应,即能使铝完全反应,测定结果准确;若选用硫酸,由于硫酸不与SiO2发生反应,可能会使硫酸不能与SiO2包裹的铝反应,导致测定结果不准确.即答案为:NaOH溶液;由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差.选用硫酸,其理由因为:能与硫酸反应,产生氢气,可以给一半的分数.
故答案为:NaOH溶液;由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差.
点评:本题把海水提炼金属镁、pH的计算、测定铝的质量分数的实验等结合起来,其综合性非常强,对学生知识、能力要求较高,是一则经典题目,值得细心研究.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目