题目内容
14.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)氧化性最弱的简单阳离子的结构示意图是
 .
.(3)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.
(4)Na2S溶液长期放置有硫析出,原因为2S2-+O2+2H2O=2S↓+4OH-(用离子方程式表示).
(5)已知:2SO2(g)+O2(g)?2SO3(g) 平衡常数为K1
2NO(g)+O2(g)?2NO2(g) 平衡常数为K2
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数为K3=$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$(用K1、K2来表达)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是bc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO2和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=$\frac{8}{3}$.
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
分析 (1)a.同一周期原子半径随着原子序数增大而减小,电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
b.同周期自左而右元素的金属性减弱、非金属性增强;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
d.硅单质为原子晶体,沸点最高;
(2)氧化性最弱的简单阳离子为Na+;
(3)发生反应:2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g),计算生成1molSi吸收的热量,注明聚集状态与反应热书写热化学方程式;
(4)空气中氧气具有氧化性,将硫离子氧化为硫单质,由电荷守恒可知还生成氢氧根离子;
(5)已知:①2SO2(g)+O2(g)?2SO3(g) 平衡常数为K1
②2NO(g)+O2(g)?2NO2(g) 平衡常数为K2
则①-②可得:2NO2(g)+2SO2(g)?2SO3(g)+2NO(g),故K32=$\frac{{K}_{1}}{{K}_{2}}$;
可逆反应到达平衡时,正、逆反应速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些物理量不变,注意判断化学平衡的物理量应随反应进行发生不变,该物理量由变化到不变化,说明反应到达平衡;
假设NO2与SO2的起始物质的量分别为1mol、2mol,平衡时参加反应的NO2为xmol,利用三段式表示出平衡时各组分的物质的量,结合平衡时NO2与SO2体积比为1:6列方程计算x的值,可得平衡时各组分物质的量,由于反应前后气体的化学计量数不变,用物质的量代替浓度代入平衡常数表达式K=$\frac{c(S{O}_{3})×c(NO)}{c(N{O}_{2})×c(S{O}_{2})}$计算;
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,一种是无氧酸盐,应为KCl,另一种盐的阴阳离子个数比为1:1,由电子转移守恒可知该盐为KClO4.
解答 解:(1)a.同一周期,原子半径随着原子序数增大而减小,简单离子半径先减小、后增大、再减小,故a错误;
b.同周期自左而右元素的金属性减弱、非金属性增强,故b正确;
c.应描述为最高价氧化物的水化物碱性减弱、酸性增强,故c错误;
d.Na、Mg、Al为金属晶体,沸点升高,Si单质为原子晶体,沸点最高,而磷、硫、氯气为分子晶体,沸点低于Si,故d错误,
故选:b;
(2)氧化性最弱的简单阳离子为Na+,离子结构示意图为: ,
,
故答案为: ;
;
(3)发生反应:2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g),1120gSi的物质的量=$\frac{1120g}{28g/mol}$=40mol,生成40mol纯硅需要吸收akJ热量,则生成1mol纯硅吸收的热量为0.025kJ热量,其热化学方程式为2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1,
故答案为:2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1;
(4)空气中氧气具有氧化性,将硫离子氧化为硫单质,由电荷守恒可知还生成氢氧根离子,反应离子方程式为:2S2-+O2+2H2O=2S↓+4OH-,
故答案为:2S2-+O2+2H2O=2S↓+4OH-;
(5)已知:①2SO2(g)+O2(g)?2SO3(g) 平衡常数为K1
②2NO(g)+O2(g)?2NO2(g) 平衡常数为K2
则①-②可得:2NO2(g)+2SO2(g)?2SO3(g)+2NO(g),故K32=$\frac{{K}_{1}}{{K}_{2}}$,故K3=$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$;
a.体系压强始终保持不变,故a错误;
b.混合气体颜色保持不变,说明二氧化氮浓度保持不变,反应到达平衡,故b正确;
c.SO2和NO的体积比随反应进行减小,SO2和NO的体积比保持不变,说明反应到达平衡,故c正确;
d.每消耗1 mol SO3的同时生成1molNO2,均表示逆反应速率,反应始终按1:1进行,不能说明到达平衡,故d错误;
假设NO2与SO2的起始物质的量分别为1mol、2mol,平衡时参加反应的NO2为xmol,则:
NO2(g)+SO2(g)?SO3(g)+NO(g)
开始(mol):1 2 0 0
转化(mol):x x x x
平衡(mol):1-x 2-x x x
平衡时NO2与SO2体积比为1:6,则(1-x):(2-x)=1:6,解得x=0.8,由于反应前后气体的化学计量数不变,用物质的量代替浓度计算平衡常数,故K=$\frac{c(S{O}_{3})×c(NO)}{c(N{O}_{2})×c(S{O}_{2})}$=$\frac{0.8×0.8}{(1-0.8)×(2-0.8)}$=$\frac{8}{3}$,
故答案为:$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$;bc;$\frac{8}{3}$;
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,一种是无氧酸盐,应为KCl,另一种盐的阴阳离子个数比为1:1,由电子转移守恒可知该盐为KClO4,反应方程式为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4,
故答案为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
点评 本题考查知识比较综合,涉及元素周期律、核外电子排布、热化学方程式书写、化学平衡常数有关计算、化学平衡状态判断、氧化还原反应等,属于拼合型题目,需要学生准备扎实的基础,难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案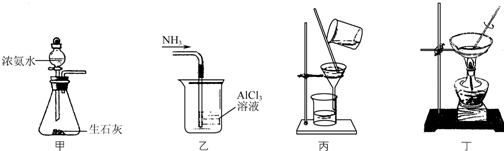
| A. | 用装置甲制取NH3 | |
| B. | 用装置乙吸收NH3制取Al(OH)3 | |
| C. | 用装置丙在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| D. | 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl |
| A. | 1,2,3三甲基苯 | B. | 丁烷 | C. | 异丙醇 | D. | 醋酸叔丁酯 |
①饱和苏打溶液 ②水玻璃 ③氯化钡 ④次氯酸钙.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①②③④ |
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH- | |
| C. | 氢氧燃料电池中,氢气在负极发生氧化反应 | |
| D. | 将地下钢管与直流电源的正极相连,用来保护钢管 |
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合液中NO3-的物质的量为0.4 mol | |
| B. | OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气 | |
| C. | 溶液中最终溶质为FeSO4 | |
| D. | c(H2SO4)为5 mol•L-1 |
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 使甲基橙变红的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:ClO-、MnO4-、Al3+、CH3CH2OH | |
| D. | 0.1mol/L的氯化铁溶液中:Na+、SO42-、Cl-、C6H5OH |
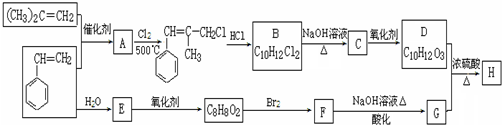
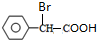 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$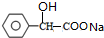 +NaBr+H2O.
+NaBr+H2O.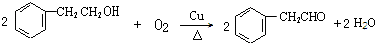 .
.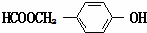 (写结构简式).
(写结构简式).