题目内容
5. 某有机物A由C、H、O三种元素组成,在一定条件下有如下转化关系,己知在相同条件下,C的蒸气密度是氢气的22倍,并可以发生银镜反应.
某有机物A由C、H、O三种元素组成,在一定条件下有如下转化关系,己知在相同条件下,C的蒸气密度是氢气的22倍,并可以发生银镜反应.写出:
(1)A→B的化学方程式C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O,反应类型消去反应.
(2)A→C的化学方程式C2H5OH+O2$→_{△}^{催化剂}$CH3CHO+H2O.
(3)D的结构简式CH3COOH,A+D→E的反应类型酯化反应或取代反应.
分析 C的蒸气密度是相同条件下氢气的22倍,则C的相对分子质量=22×2=44;有机物A,由C、H、O三种元素组成,发生催化氧化得到C,且可发生银镜反应,含有-CHO,结合相对分子质量可知,剩余基团式量为44-29=15,为甲基,可推知C为CH3CHO,故A为CH3CH2OH;A在浓硫酸作用下发生消去反应生成B,则B为CH2═CH2;C发生氧化反应生成D,则D为CH3COOH;乙酸与乙醇发生酯化反应得到E,则E为CH3COOCH2CH3,据此进行解答.
解答 解:C的蒸气密度是相同条件下氢气的22倍,则C的相对分子质量=22×2=44;有机物A,由C、H、O三种元素组成,发生催化氧化得到C,且可发生银镜反应,含有-CHO,结合相对分子质量可知,剩余基团式量为44-29=15,为甲基,可推知C为CH3CHO,故A为CH3CH2OH;A在浓硫酸作用下发生消去反应生成B,则B为CH2═CH2;C发生氧化反应生成D,则D为CH3COOH;乙酸与乙醇发生酯化反应得到E,则E为CH3COOCH2CH3,
(1)A→B的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O,属于消去反应,
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O2O;消去反应;
(2)A→C的化学方程式为:C2H5OH+O2$→_{△}^{催化剂}$CH3CHO+H2O,
故答案为:C2H5OH+O2$→_{△}^{催化剂}$CH3CHO+H2O;
(3)D的结构简式为CH3COOH;A+D→E的反应为乙酸与乙醇反应生成乙酸乙酯和水,该反应为酯化反应,也属于取代反应,
故答案为:CH3COOH;酯化反应或取代反应.
点评 本题考查有机推断,题目难度中等,注意掌握常见有机物结构与性质,明确有机反应类型及判断方法,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 淀粉 聚异戊二烯 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 纤维素 涤纶 |
| A. |  属于酯类 属于酯类 | B. | 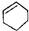 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 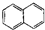 属于脂环化合物 属于脂环化合物 | D. | 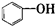 属于芳香烃 属于芳香烃 |
| A. | 高温下,5.6 g Fe与足量水蒸气完全反应失去电子数为3×6.02×1022 | |
| B. | FeCl3溶液蒸干、灼烧至恒重,最终剩余固体是FeCl3 | |
| C. | 电解精炼铜时,阳极泥中常含有金属金、银、锌等 | |
| D. | 向0.1 mol•L-1 氨水中加少量水,pH减小,c(OH-)/c(NH3•H2O)增大 |
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀 HNO3与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 碳酸钙与醋酸反应:CO32-+2H+═H2O+CO2↑ |
(2 ) 有A、B、C、D四种金属,已知用B与C相连作电极放入硫酸铜溶液中C的质量增加.B与A相连插入稀硫酸时A不断溶解.按下表中装置进行实验,根据实验现象填表:
| 装置 |  |  |
| 现象 | 电子流入C极 | A上有气体产生 |
| 正极反应式 | ||
| 四种金属由弱到强顺序 | ||
A SO2 与SO3浓度相等时 B 气体的密度恒定时 C 2V正(O2 )=V逆(SO3)

| A. | Pt片c上发生的反应为2H++2e-=H2↑,c周围变为红色 | |
| B. | b电极周围有白色沉淀生成 | |
| C. | Z单质的金属活动性较Cu强 | |
| D. | 装置A、B之间倒置的U形管,是沟通两装置的离子通道 |
| A. | 用食醋清洗水瓶内壁附着水垢(CaCO3) | |
| B. | 用小苏打发酵面粉制作馒头 | |
| C. | 自来水中通入少量Cl2进行杀菌消毒 | |
| D. | 用SO2漂白食品 |