题目内容
13.下列说法中正确的是( )| A. | 高温下,5.6 g Fe与足量水蒸气完全反应失去电子数为3×6.02×1022 | |
| B. | FeCl3溶液蒸干、灼烧至恒重,最终剩余固体是FeCl3 | |
| C. | 电解精炼铜时,阳极泥中常含有金属金、银、锌等 | |
| D. | 向0.1 mol•L-1 氨水中加少量水,pH减小,c(OH-)/c(NH3•H2O)增大 |
分析 A.高温下,Fe和水蒸气反应方程式为3Fe+4H2O(g)$\frac{\underline{\;加热\;}}{\;}$Fe3O4+4H2,5.6gFe的物质的量是0.1mol,该反应中部分Fe元素化合价由0价变为+3价、部分铁元素化合价由0价变为+2价;
B.氯化铁是强酸弱碱盐,铁离子水解生成氢氧化铁和盐酸,升高温度促进氯化铁水解;
C.电解精炼粗铜时,阳极上Cu、Zn易失电子;
D.一水合氨是弱电解质,加水稀释氨水促进一水合氨电离,溶液中n(OH-)增大、n(NH3•H2O)减小.
解答 解:A.高温下,Fe和水蒸气反应方程式为3Fe+4H2O(g)$\frac{\underline{\;加热\;}}{\;}$Fe3O4+4H2,5.6gFe的物质的量是0.1mol,该反应中部分Fe元素化合价由0价变为+3价、部分铁元素化合价由0价变为+2价,所以Fe完全反应转移电子数小于3×6.02×1022,故A错误;
B.氯化铁是强酸弱碱盐,铁离子水解生成氢氧化铁和盐酸,升高温度促进氯化铁水解,蒸干溶液时得到的固体是氢氧化铁,灼烧氢氧化铁,氢氧化铁分解生成氧化铁,所以最后得到的固体是氧化铁,故B错误;
C.电解精炼粗铜时,阳极上Cu、Zn易失电子,Ag、Au以单质形式进入溶液而形成阳极泥,故C错误;
D.一水合氨是弱电解质,加水稀释氨水促进一水合氨电离,溶液中n(OH-)增大、n(NH3•H2O)减小,
溶液中n(OH-)增大但小于溶液体积增大程度,所以c(OH-)减小,溶液的pH减小;n(OH-)/n(NH3•H2O)增大,溶液体积相同,所以c(OH-)/c(NH3•H2O)增大,故D正确;
故选D.
点评 本题考查弱电解质的电离、电解精炼粗铜、盐类水解、氧化还原反应计算等知识点,侧重据此基本理论及基本计算,易错选项是D,注意加水稀释氨水时,n(OH-)增大、c(OH-)减小,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 | |
| B. | 乙醇能使蛋白质变性,可用75%的乙醇溶液作医疗消毒剂 | |
| C. | 油脂能发生皂化反应,可用热的烧碱溶液去除试管内壁油脂 | |
| D. | 淀粉能与单质碘发生显色反应,可用碘水鉴别淀粉和纤维素 |
| A. | 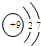 | B. | 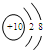 | C. |  | D. |  |
| A. | 241Am的中子数与电子数之差为146 | B. | 241Am与243Am的核外电子数相等 | ||
| C. | 241Am与243Am是同种核素 | D. | 241Am与243Am的化学性质不同 |
 和
和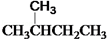 ⑦
⑦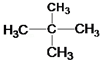 和 CH3CH2CH2CH3
和 CH3CH2CH2CH3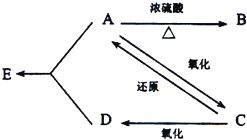 某有机物A由C、H、O三种元素组成,在一定条件下有如下转化关系,己知在相同条件下,C的蒸气密度是氢气的22倍,并可以发生银镜反应.
某有机物A由C、H、O三种元素组成,在一定条件下有如下转化关系,己知在相同条件下,C的蒸气密度是氢气的22倍,并可以发生银镜反应.
 .
.