题目内容
17.(1)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要吸收的能量为aKJ,bKJ,cKJ,则1molN2生成NH3需要放出热量6b-3a-cKJ.(2 ) 有A、B、C、D四种金属,已知用B与C相连作电极放入硫酸铜溶液中C的质量增加.B与A相连插入稀硫酸时A不断溶解.按下表中装置进行实验,根据实验现象填表:
| 装置 |  |  |
| 现象 | 电子流入C极 | A上有气体产生 |
| 正极反应式 | ||
| 四种金属由弱到强顺序 | ||
A SO2 与SO3浓度相等时 B 气体的密度恒定时 C 2V正(O2 )=V逆(SO3)
分析 (1)依据反应焓变=反应物键能总和-生成物键能总和计算焓变,进而计算放出的热量;
(2)用B与C相连作电极放入硫酸铜溶液中C的质量增加,说明C为正极,B为负极,则活动性B>C,B与A相连插入稀硫酸时A不断溶解,A为负极,则活动性A>B,C、D形成原电池,电子流入C极,则C为正极,D为负极,活动性D>C,A、D形成原电池A上有气体产生,则A为正极,D为负极,活动性D>A,则活动性D>A>B>C;
(3)根据v=$\frac{△c}{△t}$结合反应速率之比与化学计量数关键计算;达到平衡时,正逆反应速率相等,各物质的浓度不变.
解答 解:(1)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的反应焓变=(c+3a-6b)kJ/mol,
热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=(-6b+c+3a)kJ/mol,
则1molN2生成NH3需要放出热量(6b-3a-c)KJ,
故答案为:6b-3a-c;
(2)用B与C相连作电极放入硫酸铜溶液中C的质量增加,说明C为正极,B为负极,则活动性B>C,B与A相连插入稀硫酸时A不断溶解,A为负极,则活动性A>B,C、D形成原电池,电子流入C极,则C为正极,D为负极,活动性D>C,正极反应式为Cu2++2e-=Cu,A、D形成原电池A上有气体产生,则A为正极,D为负极,活动性D>A,正极反应式为2H++2e-=H2↑,则活动性D>A>B>C,
故答案为:Cu2++2e-=Cu;2H++2e-=H2↑;D>A>B>C;
(3)v(SO2)=$\frac{\frac{4mol-2.5mol}{2L}}{5s}$=0.15mol/(L•s),v(O2)=$\frac{1}{2}$v(SO2)=0.075mol/(L•s),
A.由于平衡常数未知,则不能确定浓度相等是否达到平衡状态,故A错误;
B.反应体积不变,则无论是否达到平衡状态,密度都不变,故B错误;
C.2V正(O2 )=V逆(SO3),说明正逆反应速率相等,达到平衡状态,故C正确.
故答案为:0.075mol/(L•s);C.
点评 本题考查较为综合,涉及化学反应与能量变化,原电池以及化学平衡状态等知识,为高频考点,侧重于学生的分析、计算能力的考查,注意把握比较金属活动性的角度,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 钋原子的核外电子数是16 | |
| B. | 钋(Po)-210原核内中子数与质子数之差是42 | |
| C. | 钋是金属元素,最外层电子数小于4 | |
| D. | 钋元素的相对原子质量是210 |
| A. | 胶体与溶液的本质区别是胶体粒子的直径1-100 nm | |
| B. | 胶体粒子很小,能透过半透膜 | |
| C. | 向氢氧化铁胶体中滴加盐酸,可能的现象是先产生红褐色沉淀,后沉淀逐渐溶解 | |
| D. | 雾是气溶胶,在阳光的照射下可见到丁达尔现象 |
 和
和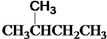 ⑦
⑦ 和 CH3CH2CH2CH3
和 CH3CH2CH2CH3 某有机物A由C、H、O三种元素组成,在一定条件下有如下转化关系,己知在相同条件下,C的蒸气密度是氢气的22倍,并可以发生银镜反应.
某有机物A由C、H、O三种元素组成,在一定条件下有如下转化关系,己知在相同条件下,C的蒸气密度是氢气的22倍,并可以发生银镜反应.
 .
. .
. 一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为: