题目内容
4.不能作为元素周期表中元素排列顺序的依据的是( )| A. | 原子的核电荷数 | B. | 原子的核外电子数 | ||
| C. | 原子的质子数 | D. | 原子的中子数 |
分析 根据元素周期表的排列顺序的依据是原子序数,而原子序数=原子的核电荷数=原子的核外电子数=原子的质子数.
解答 解:因元素周期表的排列顺序的依据是原子序数,而原子序数=原子的核电荷数=原子的核外电子数=原子的质子数,故选:D.
点评 本题主要考查了原子序数、原子的核电荷数、原子的核外电子数、原子的质子数之间的关系.

练习册系列答案
相关题目
6.分子式为C5H10Cl2的有机分子中,所含有的甲基数不可能为( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
12.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示.下列说法不正确的是( )


| A. | 原子半径:Y>Z>X | |
| B. | 若Y的氧化物为两性氧化物,则Z的一种单质在空气中易自燃 | |
| C. | 若X的气态氢化物与Z的最高价氧化物的水化物能反应,则生成的盐仅有一种 | |
| D. | 若Y与Z的核电荷数之和为X的4倍,则X、Y、Z的氢化物分子的立体构型分别为:V形,三角锥形,直线形 |
19.分子式为C3H8O的醇与C4H8O2的羧酸浓H2SO4存在时共热生成的酯有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.已知N2和H2合成氨的反应是放热反应,破坏1mol N≡N键消耗的能量为Q1kJ,破坏1mol H-H键消耗的能量为Q2kJ,形成1mol N-H键放出的能量为Q3kJ,下列关系式中正确的是( )
| A. | Q1+3Q2>6Q3 | B. | Q1+3Q2<6Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
14.下列说法正确的是( )
| A. | 所有放热反应均是自发反应,也是熵增大的反应 | |
| B. | 向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度 | |
| C. | 锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢 | |
| D. | 用电解法精炼粗铜时,粗铜板作阳极,纯铜板作阴极 |
 ,(2)H2O2:
,(2)H2O2: ,
, ,(4)CO2:
,(4)CO2: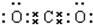 .
.
 ,它可能的结构数目是( )
,它可能的结构数目是( )