题目内容
14.下列说法正确的是( )| A. | 所有放热反应均是自发反应,也是熵增大的反应 | |
| B. | 向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度 | |
| C. | 锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢 | |
| D. | 用电解法精炼粗铜时,粗铜板作阳极,纯铜板作阴极 |
分析 A、依据反应自发进行的判断依据分析判断,若反应自发进行△H-T△S<0;
B、依据沉淀转化的原理应是想更难溶的方向进行;
C、加入硫酸铜和锌反应生成铜析出在锌表面在硫酸中形成原电池,加快反应速率;
D、电解精炼铜时,粗铜作阳极,纯铜作阴极.
解答 解:A、依据反应自发进行的判断依据分析判断,若反应自发进行△H-T△S<0;放热反应均不一定是自发反应,不一定是熵增大的反应,故A错误;
B、依据沉淀转化的原理应是想更难溶的方向进行;向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度大于有AgI的溶解度,故B错误;
C、加入硫酸铜和锌反应生成铜析出在锌表面在硫酸中形成原电池,加快反应速率;故C错误;
D、电解精炼铜时,阳极上失电子发生氧化反应,所以粗铜作阳极,纯铜作阴极,故D正确.
故选:D;
点评 本题考查了自发进行的判断方法和放热反应的分析应用,沉淀转化的原理,原电池的工作原理应用,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
4.不能作为元素周期表中元素排列顺序的依据的是( )
| A. | 原子的核电荷数 | B. | 原子的核外电子数 | ||
| C. | 原子的质子数 | D. | 原子的中子数 |
2.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低? | |
| D. | 将水加热,Kw增大,pH变小 |
19.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | W、X、Y三种元素最低价氢化物的稳定性依次降低 | |
| B. | X、Z、W的最高价氧化物对应的水化物酸性最强的是X | |
| C. | 五种元素均为非金属元素 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
6.下列说法不正确的是( )
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | C3H6不只表示一种物质 | |
| D. | 烯烃中各同系物中碳的质量分数相同 |
3.禁止用工业酒精配制饮料酒,这是因为工业酒精中常含有会使人中毒的( )
| A. | 乙醇 | B. | 乙酸 | C. | 乙酸乙酯 | D. | 甲醇 |
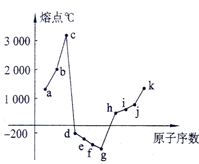 在1-18号元素中,部分连号元素单质的熔点情况如图所示,试回答:
在1-18号元素中,部分连号元素单质的熔点情况如图所示,试回答: 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.