题目内容
12.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示.下列说法不正确的是( )
| A. | 原子半径:Y>Z>X | |
| B. | 若Y的氧化物为两性氧化物,则Z的一种单质在空气中易自燃 | |
| C. | 若X的气态氢化物与Z的最高价氧化物的水化物能反应,则生成的盐仅有一种 | |
| D. | 若Y与Z的核电荷数之和为X的4倍,则X、Y、Z的氢化物分子的立体构型分别为:V形,三角锥形,直线形 |
分析 A.电子层数越多原子半径越大,电子层数相同时,原子序数越大,半径越小;
B.若Y的氧化物为两性氧化物,则Y为Al,Z为P;
C.若X的气态氢化物与Z的最高价氧化物的水化物能反应,则X为N,Z为S;
D.若Y与Z的核电荷数之和为X的4倍,设X的原子序数为x,则Y为x+7,Z为x+9,4x=x+7+x+9,所以x=8,即X为O,Y为P,Z为Cl.
解答 解:A.电子层数越多原子半径越大,电子层数相同时,原子序数越大,半径越小,则原子半径:Y>Z>X,故A正确;
B.若Y的氧化物为两性氧化物,则Y为Al,Z为P,白磷在空气中易自燃,故B正确;
C.若X的气态氢化物与Z的最高价氧化物的水化物能反应,则X为N,Z为S,氨气与硫酸形成的盐有2种,硫酸铵和硫酸氢铵,故C错误;
D.若Y与Z的核电荷数之和为X的4倍,设X的原子序数为x,则Y为x+7,Z为x+9,4x=x+7+x+9,所以x=8,即X为O,Y为P,Z为Cl,O、P、Cl的氢化物分子的立体构型分别为:V形,三角锥形,直线形,故D正确.
故选C.
点评 本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,注意对基础知识全面掌握.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
14.下列两种气体的分子数一定相等的是( )
| A. | 等温等体积的O2和N2 | B. | 等压等体积的N2和CO2 | ||
| C. | 质量相等、密度不等的N2和C2H4 | D. | 体积相等、密度不等的CO和C2H4 |
7.下列实验方案能达到目的是( )
| A. | 除去Fe粉中混有的I2:加热使I2升华 | |
| B. | 除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶 | |
| C. | 除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶 | |
| D. | 除去氯气中含有的氯化氢气体:用饱和食盐水洗涤后干燥 |
4.不能作为元素周期表中元素排列顺序的依据的是( )
| A. | 原子的核电荷数 | B. | 原子的核外电子数 | ||
| C. | 原子的质子数 | D. | 原子的中子数 |
1.下列物质中,只含有离子键,不含有共价键的是( )
| A. | CaCl2 | B. | KOH | C. | HCl | D. | NH4 NO3 |
2.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低? | |
| D. | 将水加热,Kw增大,pH变小 |

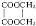 +2H2O,反应类型是酯化反应.
+2H2O,反应类型是酯化反应.