题目内容
6.设阿伏加德罗常数的值为NA,则下列说法不正确的是( )| A. | 1mol Na参加氧化还原反应时电子转移NA | |
| B. | 3.2g SO2与2.3g NO2所含有的氧原子数相等 | |
| C. | 标准状况下,2.24L SO3含有的O原子数为0.3NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
分析 A.参加氧化反应时Na化合价由0价变化为+1价;
B.结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子构成计算;
C.标准状况下SO3为液体;
D.根据n=cV计算.
解答 解:A.Na原子最外层电子数为1,则1molNa失去1mol电子,数目为NA,故A正确;
B.n(SO2)=$\frac{3.2g}{64g/mol}$=0.05mol,n(NO2)=$\frac{2.3g}{46g/mol}$=0.05mol,则所含有的氧原子的物质的量都为0.1mol,数目相等,故B正确;
C.标准状况下SO3为液体,2.24L不是0.1mol,故C错误;
D.1L 0.1mol/LMgCl2溶液中Cl-离子的物质的量为1L×0.1mol/L×2=0.2mol,则Cl-离子数为0.2NA,故D正确.
故选C.
点评 本题综合考查物质的量的相关计算,侧重于学生的分析、计算能力的考查,注意把握物质的构成特点以及化学计量使用的条件,把握相关计算公式的运用,难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
16.下列说法中,正确的是( )
| A. | 氯原子和氯离子的化学性质相同 | B. | 一价氯负离子比氯原子多一个电子 | ||
| C. | 氯气有毒,氯离子也有毒 | D. | 氯气和氯离子都显黄绿色 |
17.下列烷烃进行一氯代反应后,只生成3种沸点不同的产物的烷烃是( )
| A. | ( CH3)2CH( CH2)2 CH3 | B. | CH3 CH2 CH( CH3) CH2 CH3 | ||
| C. | ( CH3)2CHCH2CH( CH3)2 | D. | ( CH3)3 C CH2 CH3 |
14.胶体区别于其它分散系最本质的特征是( )
| A. | 外观均一 | B. | 能发生丁达尔效应 | ||
| C. | 很稳定 | D. | 分散系粒子直径介于10-9m~10-7m |
1.用N2和CO2 组成的混合气体,其相对于氢气的密度为18,则此混合气体中N2和CO2的物质的量之比为( )
| A. | 3:4 | B. | 1:2 | C. | 2:3 | D. | 1:1 |
16.能说明元素X的气态原子得电子能力比元素Y的气态原子得电子能力强的事实是( )
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | X与Y同主族,相同温度时,二者的单质与铜反应分别生成Cu2X CuY |
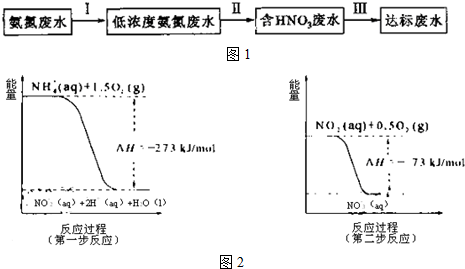
 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.