题目内容
19.下列离子方程式书写正确的是( )| A. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| B. | 碳酸氢钠溶于盐酸:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与NaOH溶液混合:HSO4-+OH-=H2O+SO42- | |
| D. | 石灰石溶于硝酸:CO32-+2H+=H2O+CO2↑ |
分析 A.氧化物书写离子方程式时写成化学式;
B.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水;
C.硫酸氢钠为强电解质,硫酸氢根离子必须拆开;
D.石灰石为碳酸钙,碳酸钙为难溶物,离子方程式中不能拆开.
解答 解:A.氧化物应该写成化学式,正确的离子方程式为:CuO+2H+═H2O+Cu2+,故A错误;
B.碳酸氢钠溶于盐酸的离子方程式为:HCO3-+H+=H2O+CO2↑,故B正确;
C.硫酸氢钠溶液与NaOH溶液混合,二者反应生成硫酸钠和水,硫酸氢根离子需要拆开,正确的离子方程式为:H++OH-=H2O,故C错误;
D.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
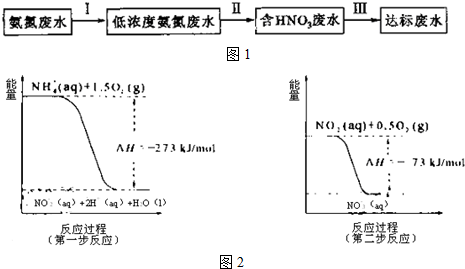
9.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.
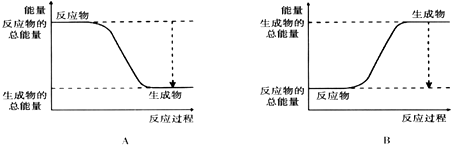
(3)从断键和成键的角度分析上述反应中能量的变化.
请填写下表:
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.其中,氢气在负极发生氧化反应.电路中每转移0.2mol电子,标准状况下消耗H2的体积是2.24L.
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.

(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
7.下列情况下,反应速率相同的是( )
| A. | 等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 | |
| B. | 等质量锌粒和锌粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 | |
| D. | 等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
14.胶体区别于其它分散系最本质的特征是( )
| A. | 外观均一 | B. | 能发生丁达尔效应 | ||
| C. | 很稳定 | D. | 分散系粒子直径介于10-9m~10-7m |
8.设NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 1.7 g羟基所含有的电子数为NA | |
| B. | 标准状况下,11.2L苯含有的氢原子数为3NA | |
| C. | 28 g乙烯和环丙烷(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1mol乙醇和1mol乙酸和浓硫酸共热,充分反应后生成乙酸乙酯分子数为NA |
9.由于做实验时不小心使皮肤粘上了一些高锰酸钾粉末,形成的黑斑很久才能消除.如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+C2O42-+H+→CO2↑+Mn2++□. 则下列有关叙述正确的是.
| A. | 发生还原反应的是C2O42- | |
| B. | 该离子方程式右侧方框内的产物是OH- | |
| C. | 10mol H+参加反应时,电子转移5mol | |
| D. | 1mol草酸分子中含有9mol共用电子对 |
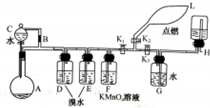 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目: