题目内容
100mL Al2(SO4)3、K2SO4、KAl(SO4)2的混合液中,如果SO42-的浓度等于0.4mol/L,当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
| A、0.2mol?L-1 |
| B、0.05mol?L-1 |
| C、0.45mol?L-1 |
| D、0.225mol?L-1 |
考点:离子方程式的有关计算,镁、铝的重要化合物
专题:计算题
分析:当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=
×2mol/L×0.05L=0.025mol,根据原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),以此计算.
| 1 |
| 4 |
解答:
解:当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=
×2mol/L×0.05L=0.025mol,则c(Al3+)=0.25mol/L,
原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),c(K+)=2×0.4mol/L-0.25mol/L×3=0.05mol/L,
故选B.
| 1 |
| 4 |
原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),c(K+)=2×0.4mol/L-0.25mol/L×3=0.05mol/L,
故选B.
点评:本题考查有关混合物的计算,为高频考点,注意铝离子物质的量的计算和电荷守恒的角度解答是解题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在下列物质中,硫元素为+4价的是( )
| A、H2S |
| B、SO2 |
| C、S |
| D、H2SO4 |
元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数).下列说法正确的是( )


| A、X、Y不可能均为非金属元素 |
| B、若X为Fe,Y只能为Cl |
| C、X一定为金属元素 |
| D、若X为Fe.Y可为Cl、Br,但不能是I |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法不正确的是( )
| 180℃ |
| 催化剂 |
| A、每转化掉1mol NO和1mol NO2混合气体,反应转移6mol电子 |
| B、升高温度,可使该反应的反应速率增大 |
| C、平衡时,其他条件不变,升高温度则该反应的平衡常数减少 |
| D、其他条件不变,使用高效催化剂平衡会发生移动,氮氧化物的转化率增大 |
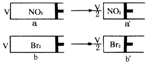 两个体积相同带活塞的容器,分别盛装一定量的NO2和Br2(g),都为一样的红棕色,迅速将两容器同时压缩到原来的一半(如图)假设气体不液化,则下列说法正确的是( )
两个体积相同带活塞的容器,分别盛装一定量的NO2和Br2(g),都为一样的红棕色,迅速将两容器同时压缩到原来的一半(如图)假设气体不液化,则下列说法正确的是( )| A、a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅 |
| B、a′,b′的颜色一样深 |
| C、a′的压强比a的压强2倍要小,b′的压强为b的压强的2倍 |
| D、a′中的c(NO2)一定比b′中的c(Br2 )小 |
某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为2:3,可以说( )
| A、该有机物中含C、H、O三种原子 |
| B、该化合物是乙烷 |
| C、该化合物中C、H原子个数比为1:3 |
| D、该化合物分子中含2个C原子、6个H原子,但一定不含有O原子 |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、8g甲烷含有的共价键数约为NA |
| B、常温常压下,22.4L二氧化碳原子总数为3NA |
| C、2.8g铁粉与足量稀硝酸反应,转移0.15NA个电子 |
D、 3.2g硫(结构见图)含S-S键的数目为0.8NA 3.2g硫(结构见图)含S-S键的数目为0.8NA |
为了除去CuCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
| A、Na2CO3 |
| B、NaOH |
| C、NH3?H2O |
| D、CuO |
 在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
在一定条件下,物质A~E相互转化的关系下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):