题目内容
把6.4g铜投入到一定量的浓硝酸溶液中去,充分反应后铜无剩余,收集到标况下气体2.24L.
(1)反应后收集到的是 气体.
(2)生成的气体在标况下的体积各为多少ml?
(1)反应后收集到的是
(2)生成的气体在标况下的体积各为多少ml?
考点:化学方程式的有关计算
专题:计算题
分析:(1)利用极限法分析,假设生成的气体为NO或NO2,根据电子转移守恒计算其物质的量判断组成;
(2)若为单一气体,其体积为2.24L,若为NO、NO2混合气体,令NO和NO2各自物质的量为xmol、ymol,根据电子转移守恒及二者物质的量列方程,进而计算各自体积.
(2)若为单一气体,其体积为2.24L,若为NO、NO2混合气体,令NO和NO2各自物质的量为xmol、ymol,根据电子转移守恒及二者物质的量列方程,进而计算各自体积.
解答:
解:(1)气体的物质的量=
=0.1mol,6.4g铜的物质的量=
=0.1mol,
若气体为NO,由电子转移守恒可知,n(NO)=
=0.067mol,
若气体为NO2,由电子转移守恒可知,n(NO2)=
=0.2mol,
而0.067mol<0.1mol<0.2mol,故气体为NO、NO2混合气体,
故答案为:NO、NO2;
(2)令NO和NO2各自物质的量为xmol、ymol,根据电子转移守恒及二者物质的量,则:
解得x=y=0.05
故V(NO)=V(NO2)=0.05mol×22.4L/mol=1.12L,即V(NO)=V(NO2)=112mL,
答:生成的NO、NO2气体的体积各为112mL.
| 2.24L |
| 22.4L/mol |
| 6.4g |
| 64g/mol |
若气体为NO,由电子转移守恒可知,n(NO)=
| 0.1mol×2 |
| 5-2 |
若气体为NO2,由电子转移守恒可知,n(NO2)=
| 0.1mol×2 |
| 5-4 |
而0.067mol<0.1mol<0.2mol,故气体为NO、NO2混合气体,
故答案为:NO、NO2;
(2)令NO和NO2各自物质的量为xmol、ymol,根据电子转移守恒及二者物质的量,则:
|
解得x=y=0.05
故V(NO)=V(NO2)=0.05mol×22.4L/mol=1.12L,即V(NO)=V(NO2)=112mL,
答:生成的NO、NO2气体的体积各为112mL.
点评:本题考查化学方程式有关计算,利用极限法判断气体的成分是关键,注意利用电子转移守恒解答.

练习册系列答案
相关题目
常温时,下列各溶液中有关粒子浓度的说法正确的是( )
| A、pH=5的NaHSO3溶液:c(HSO3-)>c(SO32-)>c(H2SO3) |
| B、pH=3的盐酸跟pH=11的氨水等体积混合:c(H+)>c(OH-) |
| C、pH<7的CH3COONa和CH3COOH的混合溶液 c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、pH=12的NaOH溶液中:c(OH-)水电离=1.0×10-12mol/L |
参照反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是( )


| A、反应物具有的总能量大于生成物具有的总能量 |
| B、正反应为吸热反应 |
| C、该反应的逆反应是吸热过程 |
| D、从图中可以看出,HBr的能量一定高于H2的能量 |
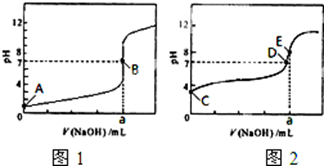 (1)常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HCl溶液和20.00mL 0.1000mol?L-1 CH3COOH溶液,得到2条滴定曲线,如图所示.
(1)常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HCl溶液和20.00mL 0.1000mol?L-1 CH3COOH溶液,得到2条滴定曲线,如图所示.