题目内容
将3.2g Cu溶于30mL a mol/L过量的硝酸中,假设硝酸的还原产物只有NO和NO2,反应结束后,将所得溶液加水稀释至1000mL,测得c(NO3-)为0.3mol/L.求:
(1)稀释后溶液中氢离子的物质的量浓度为 .
(2)生成气体中NO的物质的量为 ,NO2的物质的量为 (用含a的关系式表示).
(3)用NaOH溶液吸收氮的氧化物可以防止污染.原理为:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围是 .
(1)稀释后溶液中氢离子的物质的量浓度为
(2)生成气体中NO的物质的量为
(3)用NaOH溶液吸收氮的氧化物可以防止污染.原理为:2NO2+2NaOH═NaNO3+NaNO2+H2O;NO2+NO+2NaOH═2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围是
考点:化学方程式的有关计算
专题:计算题
分析:(1)n(Cu)=
=0.05mol,与硝酸反应生成Cu2+,加水稀释至1000mL,溶液中c(Cu2+)=
=0.05mol/L,结合电荷守恒c(NO3-)=c(H+)+2c(Cu2+),据此计算稀释后溶液的c(H+);
(2)结合电子守恒和N元素守恒计算生成的气体中NO2和NO的物质的量;
(3)由方程式可知,只有NO2,气体能完全被吸收,根据电子转移守恒可知,此时a的值最大,气体为NO和NO2,二者按1:1可以被完全吸收,故气体完全被吸收,应满足n(NO2)≥n(NO),结合(2)中的表达式计算.
| 3.2g |
| 64g/mol |
| 0.05mol |
| 1L |
(2)结合电子守恒和N元素守恒计算生成的气体中NO2和NO的物质的量;
(3)由方程式可知,只有NO2,气体能完全被吸收,根据电子转移守恒可知,此时a的值最大,气体为NO和NO2,二者按1:1可以被完全吸收,故气体完全被吸收,应满足n(NO2)≥n(NO),结合(2)中的表达式计算.
解答:
解:(1)n(Cu)=
=0.05mol,与硝酸反应生成Cu2+,加水稀释至1000mL,溶液中c(Cu2+)=
=0.05mol/L,
根据溶液的电荷守恒可知溶液中存在2c(Cu2+)+c(H+)=c(NO3-),则c(H+)=0.3moL/L-2×0.05mol/L=0.2mol/L,
故答案为:0.2 mol/L;
(2)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.3,
解之得:x=(0.045a-0.5)mol,y=(0.2-0.015a)mol;
故答案为:(0.2-0.015a)mol;(0.045a-0.5)mol;
(3)如硝酸全部被还原为NO2,由转移电子数目相等可知,生成的NO2物质的量为n(NO2)=2n(Cu)=2×0.05mol=0.1mol,则0.045a-0.5=0.1,解得a=
,由于为混合气体,故a<
,
如生成NO和NO2,气体完全被吸收,则由反应2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O可知,应满足n(NO2)≥n(NO),即:(0.045a-0.5)mol≥(0.2-0.015a)mol,解得a≥
,
故a的取值范围是
≤a<
,
故答案为:
≤a<
.
| 3.2g |
| 64g/mol |
| 0.05mol |
| 1L |
根据溶液的电荷守恒可知溶液中存在2c(Cu2+)+c(H+)=c(NO3-),则c(H+)=0.3moL/L-2×0.05mol/L=0.2mol/L,
故答案为:0.2 mol/L;
(2)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.3,
解之得:x=(0.045a-0.5)mol,y=(0.2-0.015a)mol;
故答案为:(0.2-0.015a)mol;(0.045a-0.5)mol;
(3)如硝酸全部被还原为NO2,由转移电子数目相等可知,生成的NO2物质的量为n(NO2)=2n(Cu)=2×0.05mol=0.1mol,则0.045a-0.5=0.1,解得a=
| 40 |
| 3 |
| 40 |
| 3 |
如生成NO和NO2,气体完全被吸收,则由反应2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O可知,应满足n(NO2)≥n(NO),即:(0.045a-0.5)mol≥(0.2-0.015a)mol,解得a≥
| 35 |
| 6 |
故a的取值范围是
| 35 |
| 3 |
| 40 |
| 3 |
故答案为:
| 35 |
| 3 |
| 40 |
| 3 |
点评:本题考查混合物计算、根据方程式计算,侧重于学生的分析能力和计算能力的考查,判断气体完全吸收满足的条件是关键,属于字母型计算,增大计算难度,为易错题目,难度中等.

练习册系列答案
相关题目
物质的性质决定着物质的用途,下列有关物质性质及其用途的说法,正确的是( )
| A、葡萄糖具有还原性,可用于医学尿糖的检验 |
| B、二氧化硫能使滴有酚酞的红色溶液褪色,说明其具有还原性 |
| C、酒精具有消毒杀菌作用,医用酒精的浓度越大,杀菌效果越好 |
| D、浓硫酸具有强氧化性,不能用于干燥硫化氢、碘化氢和二氧化硫等具有还原性的气体 |
邻羟基苯甲酸,俗名水杨酸,其结构简式为 ,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )
,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )
 ,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )
,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的( )| A、NaCl |
| B、Na2SO4 |
| C、NaOH |
| D、NaHCO3 |

 已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.
已知X(g)+Y(g)?2Z(g)+W(g)△H=-Q1kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入1molX和1molY,在500℃时充分反应,达平衡后Z的浓度为w mol/L,放出热量Q2kJ.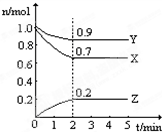 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: