题目内容
下列物质中,含有共价键的离子化合物是
| A.NH3 | B.HCl | C.NaOH | D.NaCl |
C
解析试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,则氨气、氯化氢是共价化合物。氢氧化钠是含有离子键和共价键的离子化合物,氯化钠是含有离子键的离子化合物,答案选C。
考点:考查化学键和化合物的判断
点评:该题是中等难度的试题,主要是考查学生对化学键以及化学键和化合物关系的熟悉了解程度,意在巩固学生的基础,提高学生的应试能力和学习效率。明确化学键和化合物的关系是答题的关键。

 高中必刷题系列答案
高中必刷题系列答案对P4S3分子的结构研究表明,该分子中不存在不饱和键,且各原子最外层均已达到8个电子稳定结构。则一个P4S3分子中含有的共价键个数为
| A.7个 | B.9个 | C.19个 | D.不能确定 |
下列有关化学键与晶体结构的说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.离子化合物的熔点一定比共价化合物的高 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.含有阴离子的化合物一定含有阳离子 |
科学家曾预言一种可用作炸药的物质,分子式为C(N3)4,其爆炸反应方程式为:C(N3)4=C+6N2↑,下列说法一定正确的是
| A.该物质为离子晶体 |
| B.该物质可通过C60吸附N2直接制得 |
| C.18g该物质完全分解产生13.44LN2 |
| D.C(N3)4中碳元素为正价 |
关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
| A.N5+共有34个核外电子 |
| B.N5+中氮原子间以离子键结合 |
| C.化合物N5ASF6中AS的化合价为+1价 |
| D.化合物N5ASF6为离子化合物 |
下列物质中既含有离子键又含有共价键的是
| A.H2O | B.CaCl2 | C.NaOH | D.Cl2 |
下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是
| A.2Na2O2+2CO2=2Na2CO3+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.Cl2+H2O?=?HCl+HclO | D.Na2CO3+BaCl2=BaCO3↓+2NaCl |
Ⅰ.(1)写出下列电子云的界面图表示的形成的键的类型:
①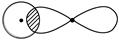
_________________________________________________________________。
②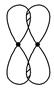
_________________________________________________________________。
③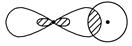
_________________________________________________________________。
④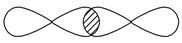
_________________________________________________________________。
(2)下列分子中,没有光学活性的是____________,含有两个手性碳原子的是
____________。
| A.乳酸CH3—CHOH—COOH |
| B.甘油CH2OH—CHOH—CH2OH |
| C.脱氧核糖CH2OH—CHOH—CHOH—CH2—CHO |
| D.核糖CH2OH—CHOH—CHOH—CHOH—CHO |
在乙烷(CH3—CH3)、乙烯(CH2=CH2)、乙炔(CH≡CH)分子中的碳碳键键长大小顺序为__________________________________。BCl3分子中Cl—B—Cl键角为__________,HgCl2分子中的键角为____________。
(3)金属键可以看成是由许多原子共用许多电子形成的,所以有人将金属键视为一种特殊形式的共价键。金属键与共价键的明显区别是①________________、②________________。
下列有关粒子间的作用力,说法正确的是
| A.HCI溶于水时.H— Cl键会断裂 |
| B.H2O2分子中只有极性键 |
| C.NH3是以非极性键结合的分子 |
| D.MgCl2中既有离子键,又有共价键 |