题目内容
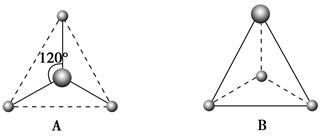
Ⅰ.(1)写出下列电子云的界面图表示的形成的键的类型:
①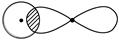
_________________________________________________________________。
②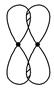
_________________________________________________________________。
③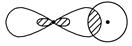
_________________________________________________________________。
④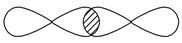
_________________________________________________________________。
(2)下列分子中,没有光学活性的是____________,含有两个手性碳原子的是
____________。
| A.乳酸CH3—CHOH—COOH |
| B.甘油CH2OH—CHOH—CH2OH |
| C.脱氧核糖CH2OH—CHOH—CHOH—CH2—CHO |
| D.核糖CH2OH—CHOH—CHOH—CHOH—CHO |
在乙烷(CH3—CH3)、乙烯(CH2=CH2)、乙炔(CH≡CH)分子中的碳碳键键长大小顺序为__________________________________。BCl3分子中Cl—B—Cl键角为__________,HgCl2分子中的键角为____________。
(3)金属键可以看成是由许多原子共用许多电子形成的,所以有人将金属键视为一种特殊形式的共价键。金属键与共价键的明显区别是①________________、②________________。
Ⅰ.(1)①s—p σ键 ②p—p π键 ③s—sp1σ键④p—p σ键
(2)B C
Ⅱ.(1)CH3—CH3>CH2=CH2>CH≡CH(C—C>C=C>C≡C)
(2)120° 180°
(3)金属键没有饱和性和方向性 金属键中的电子属于整块金属
解析

 阅读快车系列答案
阅读快车系列答案下列物质中,含有共价键的离子化合物是
| A.NH3 | B.HCl | C.NaOH | D.NaCl |
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
| A.CO2 | B.H3O+ | C.CH4 | D.H2SO4 |
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
甲:
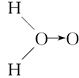 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________________________________________________________。
图形因表达准确且信息量大而得到广泛应用。请根据所给图形回答下列问题:
(1)如下图表示容器中气体粒子的示意图,图中“”和“”分别代表不同元素的原子,它们的结合体代表分子,则图中可表示氮气的是(填字母,下同)________,含有________共价键(填“极性”或“非极性”),可表示氯化氢(HCl)分子的是________,含有________共价键(填“极性”或“非极性”),可表示一氧化碳和氧气的混合气体的是________含有________共价键(填“极性”或“非极性”)。
(2)下图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是________。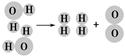
| A.生成1 mol O2需断开4 mol H—O共价键 |
| B.水分解后生成氢气和氧气的分子数比为2∶1 |
| C.水分解过程中,分子的种类不变 |
| D.水分解过程中,原子的数目不变 |
硫元素可以形成多种物质如 、SO2、SO32-、SO42-等。
、SO2、SO32-、SO42-等。
(1) 中S原子的轨道杂化类型是 ,
中S原子的轨道杂化类型是 , 的空间构型是 。
的空间构型是 。
(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子。
①[Cu(NH3)4]SO4中Cu2+的电子排布式为 。
②[Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
| A.共价键 | B.氢键 | C.离子键 | D.配位键 E.分子间作用力 |
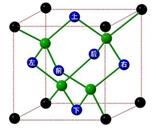
KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O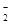 代替,则下列对于KO2晶体结构的描述正确的是
代替,则下列对于KO2晶体结构的描述正确的是
A.与K+距离相等且最近的O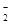 共有8个 共有8个 |
B.与K+距离相等且最近的O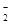 构成的多面体是正八面体 构成的多面体是正八面体 |
| C.与K+距离相等且最近的K+有8个 |
D.一个KO2晶胞中的K+和O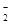 粒子数均为8个 粒子数均为8个 |