题目内容
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中的位置为_____________,NF3的分子立体构型名称是____________。类比NH3·H2O表示出代表性分子NH4F含有的氢键________________________。
(2)写出N2O的等电子体__________________(1个分子和1个离子)。
(3)Cu原子的基态外围电子排布式为____________;已知:CuO在高温下会分解成Cu2O,试从洪特规则角度解释其原因__________________________________________________。
(4) 在Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中H—C=O的键角______(填“大于”“等于”或“小于”)乙醇分子中的H—C—O的键角。
(5) 某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。其水溶液中的N4H44+遇碱生成一种形似白磷的N4分子。画出N4H44+的结构式(标明其中的配位键)__________________。
【答案】第二周期第VA族 三角锥形 N—H···F(或F—H···N) CO2(或CS2、COS、BeCl2(g))和N3—(NO2+、SCN—) 3d104s1 Cu+价电子排布式为3d10,为全充满结构,能量较低,较稳定 大于 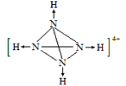
【解析】
(1)N元素为7号元素,位于第二周期第VA族;NF3的中心原子价层电子对数为![]() =4,含一对孤对电子,所以空间构型为三角锥形;NH4F含有的氢键可以表示为N—H···F(或F—H···N);
=4,含一对孤对电子,所以空间构型为三角锥形;NH4F含有的氢键可以表示为N—H···F(或F—H···N);
(2)N2O原子数为3,价电子数为5×2+6=16,原子总数相同,价电子总数相同的分子或离子为等电子体,所以其等电子体有CO2(或CS2、COS、BeCl2(g))和N3-(或NO2+、SCN-);
(3)铜原子为29号元素,根据电子排布规律可知其基态原子的外围电子排布为3d104s1;Cu+价电子排布式为3d10,为全充满结构,能量较低,较稳定,所以CuO在高温下会分解成Cu2O;
(4)醛基中碳原子采用sp2杂化,为平面三角形构型,乙醇中含有醇羟基的碳原子采用sp3杂化,为四面体构型,所以乙醛分子中H-C=O的键角大于乙醇分子中的H-C-O的键角;
(5)白磷分子为正四面体形,四个磷原子占据四个顶点,N4分子与白磷分子结构相似,说明N4分子中每个氮原子均形成3个σ键,所以在N4H44+中氢离子和N原子形成配位键,遇碱后配位键断裂形成N4,所以N4H44+的结构式应为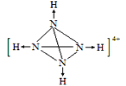 。
。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH |
B | Mg2+、Cl-、HCO | 过量NaOH溶液 | Mg2++2HCO |
C | Fe2+、NO | NaHSO4溶液 | HSO |
D | K+、CO | 通入少量CO2 | CO |