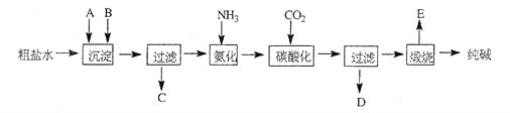
题目内容
【题目】常温下,有c(H+)=0.1mol/L的某溶液中可能有Na+、Fe3+、Fe2+、I﹣、Cl﹣、CO32﹣中的某几种,现取100mL该溶液进行如下实验:已知氧化性Fe3+>I2,根据实验结果,下列判断正确的是( )

A.Fe3+、I﹣、Cl﹣三种离子一定存在
B.不能确定Na+和Cl﹣是否存在,CO32﹣一定不存在
C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl﹣)≥0.3molL1
【答案】D
【解析】
溶液中已经含有0.1mol/L的H+,所以与其不能大量共存的![]() 一定不存在;由于加入适量Cl2的四氯化碳溶液后下层出现了紫色,说明有碘单质生成,那么原溶液中一定含有I-;由于氧化性Fe3+>I2,所以I-会被Fe3+氧化,所以原溶液中一定不会存在Fe3+;根据I2的质量为2.54g可知,100mL的原溶液含有I-0.02mol,所以原溶液中
一定不存在;由于加入适量Cl2的四氯化碳溶液后下层出现了紫色,说明有碘单质生成,那么原溶液中一定含有I-;由于氧化性Fe3+>I2,所以I-会被Fe3+氧化,所以原溶液中一定不会存在Fe3+;根据I2的质量为2.54g可知,100mL的原溶液含有I-0.02mol,所以原溶液中![]() ;对分液后的水层加入足量的氢氧化钠会生成沉淀,所以原溶液中一定有Fe2+,那么1.60g固体即Fe2O3,所以100mL原溶液中,Fe2+的量为0.02mol,即原溶液中
;对分液后的水层加入足量的氢氧化钠会生成沉淀,所以原溶液中一定有Fe2+,那么1.60g固体即Fe2O3,所以100mL原溶液中,Fe2+的量为0.02mol,即原溶液中![]() ;由于第一步中加入的Cl2会转变为Cl-,所以不能通过生成AgCl白色沉淀证明原溶液中含有Cl-;通过上述分析,原溶液中
;由于第一步中加入的Cl2会转变为Cl-,所以不能通过生成AgCl白色沉淀证明原溶液中含有Cl-;通过上述分析,原溶液中![]() ,
,![]() ,
,![]() ,电荷并不守恒,所以原溶液中一定还含有Cl-,由于上述检验过程并未证明溶液中一定不含Na+,所以
,电荷并不守恒,所以原溶液中一定还含有Cl-,由于上述检验过程并未证明溶液中一定不含Na+,所以![]() ;当
;当![]() ,溶液中不含Na+,当
,溶液中不含Na+,当![]() ,溶液中一定有Na+。
,溶液中一定有Na+。
A.通过分析可知,溶液中一定不含Fe3+,A项错误;
B.通过分析可知,原溶液中一定不含![]() ;原溶液中一定还含有Cl-,且当
;原溶液中一定还含有Cl-,且当![]() ,溶液中不含Na+,当
,溶液中不含Na+,当![]() ,溶液中一定有Na+,B项错误;
,溶液中一定有Na+,B项错误;
C.通过分析可知,溶液中含Fe2+,不含Fe3+,C项错误;
D.通过分析可知,溶液中一定含有Cl-,且![]() ,D项正确;
,D项正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,![]() 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快